INTRODUCCIÓN
El objetivo de RhD Education es ayudar a los ginecólogos-obstetras, matronas, médicos y mujeres a mantenerse informados sobre los problemas de incompatibilidad RhD entre los padres, que impactan en el desarrollo, bienestar y salud de su futuro hijo. Aunque la incompatibilidad Rh se conoce desde hace casi cien años y la profilaxis anti-Rh(D) se introdujo hace más de cincuenta años, este problema aún afecta aproximadamente al 50 % de los embarazos en el mundo, causando una mortalidad y morbilidad perinatales significativas y/o complicaciones postnatales graves.
Las recientes directrices promovidas por la FIGO (Federación Internacional de Ginecología y Obstetricia) y la ICM (Confederación Internacional de Matronas) publicadas a finales de 2021 subrayan la importancia de volver a centrar la atención en este problema. Las estrategias incluyen:
- Introducción del tipaje sanguíneo rutinario en mujeres en edad fértil o al inicio del embarazo.
- Inversión en la administración gratuita de inmunoglobulinas como prioridad de salud pública mundial.
Estos objetivos también son apoyados por el Consorcio WIRhE (Worldwide Initiative for Rh disease Eradication), creado en la Universidad de Columbia en 2018. El Consorcio ha establecido una Academia Internacional de Asesores que colaboran con este sitio web y contribuyen a mantener RhD Education actualizado y relevante. Estos asesores sirven como embajadores para la implementación de las estrategias recomendadas en muchas regiones del mundo.
El antígeno Rhesus D juega un papel crucial en la prevención de la enfermedad hemolítica del feto y del recién nacido (EHFN), también conocida como eritroblastosis fetal. La sensibilización al Rh puede provocar anemia hemolítica en el feto si no se maneja adecuadamente. La identificación temprana del gen RhD del feto y la implementación de una profilaxis anti-Rh(D) son estrategias esenciales para prevenir estas complicaciones.
RhD Education se compromete a proporcionar información precisa y actualizada sobre la incompatibilidad RhD y sus implicaciones. Siguiendo las directrices y estrategias recomendadas, podemos reducir los riesgos asociados y mejorar los resultados para las madres y sus hijos en todo el mundo.
QUÉ HAY QUE SABER SOBRE LA EHFRN
¿Cómo atacan los anticuerpos de la madre al feto en la EHFRN?
La Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN) es un trastorno causado por el ataque del sistema inmunológico materno, sensibilizado a través de anticuerpos específicos dirigidos a antígenos de grupo sanguíneo presentes en la superficie de los glóbulos rojos (GR) fetales o del recién nacido, que no se encuentran en los GR maternos. La EHFRN puede producir consecuencias patológicas que van desde la anemia hemolítica en el feto (de leve a grave) y la hidropesía fetal hasta la hiperbilirrubinemia neonatal grave y el kernícterus en el recién nacido, afecciones que pueden tener tasas significativas de morbilidad y mortalidad.
- ¿Cómo se relaciona la EHFRN con el factor Rh?
- Epidemiología
- ¿Cómo se puede prevenir la enfermedad hemolítica Rh?
- Tipos de EHFRN
- Incompatibilidad ABO
- Aloinmunización a antígenos de GR fetales o neonatales
- Sistema Rh
- ¿Qué antígeno es responsable de los casos más graves de EHFRN?
- ¿Cuál es la fisiopatología de la EHFRN?
¿Cómo se relaciona la EHFRN con el factor Rh?
El antígeno más común implicado en este mecanismo de aloinmunización por incompatibilidad antigénica es el antígeno Rhesus D (RhD), pero desde la primera descripción de la enfermedad realizada por el Dr. Louis K. Diamond en 1932, cuando escribió sobre la eritroblastosis fetal en el recién nacido basándose en frotis periféricos, se han encontrado cada vez más antígenos diferentes potencialmente implicados en la patogénesis del trastorno. La International Society of Blood Transfusion Working Party for Red Cell Immunogenetics and Blood Group Terminology (ISBT WP, Grupo de trabajo de la Sociedad Internacional de Transfusión Sanguínea sobre inmunogenética de los glóbulos rojos y terminología de los grupos sanguíneos) reconoce actualmente 43 sistemas de grupos sanguíneos que contienen 345 antígenos de glóbulos rojos.
Epidemiología
La incompatibilidad de Rh tiene una distribución mundial que varía según las zonas geográficas, la raza, la etnia y los factores de riesgo. El grupo sanguíneo Rh negativo es más predominante en las razas blancas (15%) en comparación con los afroamericanos (5% a 8%) o los asiáticos y nativos americanos (1% a 2%). Esto significa que una mujer blanca con Rh negativo tiene un 85% de probabilidades de concebir con un hombre Rh positivo.
Esta frecuente incompatibilidad Rhd aumenta el riesgo de Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN) con cualquier evento de hemorragia fetomaterna (HFM). Es importante subrayar que una cantidad de solo 0,1 ml de sangre fetal que entre en la circulación materna es suficiente para causar aloinmunización. La EHFRN puede resultar en anemia hemolítica en el feto, que puede variar de leve a grave, y en casos extremos, puede conducir a hidropesía fetal y otras complicaciones severas.
¿Cómo se puede prevenir la enfermedad hemolítica Rh?
Gracias a la prevención, la detección precoz y el manejo de esta enfermedad, posibles gracias a las mejoras en la comprensión de la fisiopatología y en los recursos farmacológicos, la incidencia y la prevalencia de la Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN) han disminuido exponencialmente en los últimos 50 años.
La inmunoprofilaxis Rhesus D negativo (RhD) se introdujo por primera vez en 1968, lo que permitió reducir la incidencia de la EHFRN del 1% de todos los recién nacidos del mundo (con casi un 50% de mortalidad) al 0,5%. La incidencia de la EHFRN disminuyó aún más, hasta el 0,1%, con la administración de inmunoprofilaxis Rh(D) antes del parto. La combinación de inmunoprofilaxis antes y después del parto tiene una eficacia de casi el 99% en la prevención de la sensibilización materna al Rh(D).
Por lo tanto, la mayoría de las directrices actuales elaboradas por diversas asociaciones de profesionales sanitarios implicados en la prevención y en el tratamiento de la EHFRN recomiendan la inmunoprofilaxis con IgG anti-Rh(D) a toda mujer Rh(D)-negativa no sensibilizada, con tiempos diferentes en función de la situación:
- A las 28 semanas de gestación durante cada embarazo.
- Inmediatamente después del parto de todo neonato Rh(D) positivo.
- En el contexto de cualquier otro evento que pudiera exponer a la madre al antígeno Rh(D) (por ejemplo, aborto, aborto espontáneo, traumatismo abdominal).
Sin embargo, teniendo en cuenta el número anual de dosis de anti-Rh(D) producidas y suministradas en todo el mundo, se ha calculado que casi el 50% de las mujeres de todo el mundo que necesitan este tipo de inmunoprofilaxis no la reciben, presumiblemente debido a la falta de concienciación, disponibilidad y/o asequibilidad, poniendo así a cientos de miles de fetos y neonatos en riesgo de contraer la enfermedad de Rh cada año.
La brecha entre la oferta y la demanda de IgG anti-Rh(D) es mayor en los países de bajos ingresos, como las superregiones de Asia del Sur y Subsahariana, Asia Oriental, los países del Sudeste y el Pacífico, los países de Europa Oriental/Asia Central, los países de América Latina y el Caribe, y los países del Norte de África/Oriente Medio; sin embargo, en los países de altos ingresos la inmunoprofilaxis para la sensibilización materna al Rh(D) también está por debajo del umbral óptimo necesario para garantizar una prevención completa.
Se necesitan más esfuerzos para superar esta situación aún extendida, empezando por una mayor concienciación sobre la enfermedad de Rh y sobre los medios para prevenirla y tratarla. Este sitio web tiene esta misión específica.
Tipos de EHFRN
La Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN), también conocida como eritroblastosis fetal, es un trastorno inmunomediado en el que los anticuerpos maternos atacan a los glóbulos rojos (GR) fetales o neonatales debido a incompatibilidades de antígenos, con hemólisis en la circulación sanguínea fetal o neonatal. La EHFRN puede causar tasas significativas de morbilidad y mortalidad, especialmente en entornos con recursos sanitarios limitados.
Los mecanismos a través de los cuales se desarrollan los anticuerpos maternos y atacan a los antígenos de los GR fetales o neonatales están representados principalmente por la incompatibilidad ABO y la aloinmunización debida a la sensibilización Rh materna a los antígenos de superficie de los GR fetales o neonatales por transfusión y hemorragia fetomaterna (HFM) durante el embarazo o en el momento del parto.
Los distintos tipos de EHFRN se clasifican en función del aloantígeno que provoca la respuesta. Los tipos incluyen ABO, anti-RhD, anti-RhE, anti-Rhc, anti-Rhe, anti-RhC, combinaciones multiantígeno y anti-Kell.
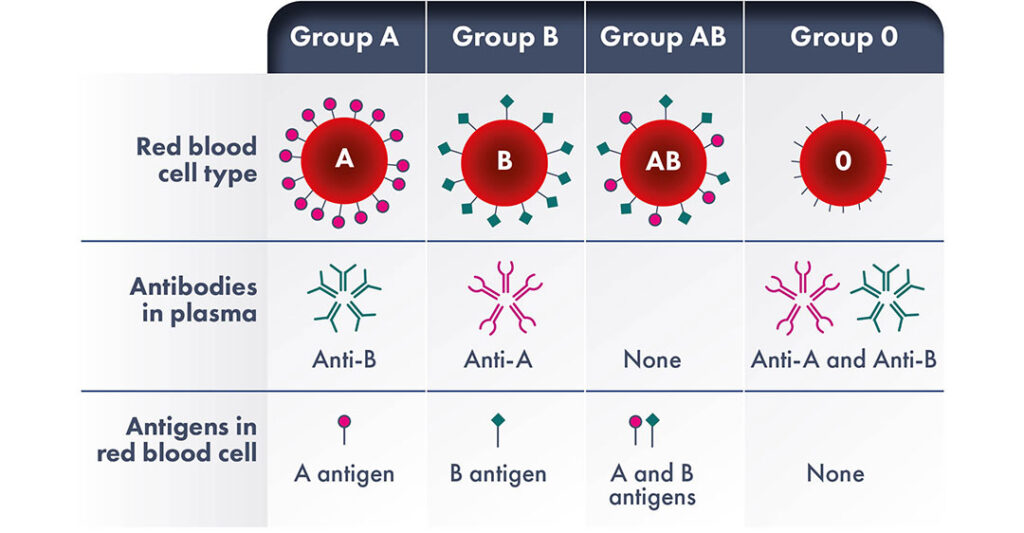
Incompatibilidad ABO
La incompatibilidad ABO es un desajuste congénito entre los grupos sanguíneos materno y fetal, que se produce en entre el 15 y el 20% de los embarazos. La incompatibilidad entre los antígenos sanguíneos del sistema ABO de la madre y el feto es la principal causa de ictericia neonatal y la forma más común de Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN). Sin embargo, la EHFRN clínica grave sólo se desarrollará en aproximadamente el 1% de los casos de desajuste de los grupos sanguíneos.
Se cree que la enfermedad generalmente más leve causada por la incompatibilidad ABO se debe a la expresión de antígenos A y B por la placenta y otros tejidos, lo que permite que estos antígenos se asocien con aloanticuerpos maternos en cierta medida. Además, la expresión de los antígenos de los grupos sanguíneos A y B en los glóbulos rojos fetales no está completamente desarrollada, reduciendo los sitios antigénicos en la superficie de los glóbulos rojos fetales a los que puedan unirse los anticuerpos.
Cabe recordar que las personas empiezan a producir de forma natural anticuerpos A y/o B contra los antígenos que no poseen aproximadamente a los 3-6 meses de edad. En consecuencia, la EHFRN ABO puede producirse con el primer embarazo sin ninguna exposición previa a antígenos extraños. A diferencia de otros tipos de EHFRN, se observa casi exclusivamente en madres con grupo sanguíneo O y es más frecuente con el grupo sanguíneo A del feto.
Las madres con grupo sanguíneo O tienen inmunoglobulinas naturales de clase G (IgG) contra los grupos sanguíneos A o B, capaces de atravesar la placenta. Durante el embarazo, puede aumentar fuertemente la formación de títulos anti-A, anti-B y anti-A, B de la clase IgG.
Las pacientes con los grupos A y B también desarrollan los respectivos anticuerpos contra los antígenos que no poseen, aunque normalmente no corren riesgo de padecer EHFRN, ya que estos anticuerpos son casi siempre de clase IgM y, por lo tanto, no pueden causar enfermedad fetal o neonatal porque no atraviesan la placenta.
En muy raras ocasiones, la incompatibilidad ABO se ha señalado como causa de anemia fetal grave y morbilidad perinatal. Existe una diferencia sorprendente, y aún no comprendida, en la incidencia de la EHFRN mediada por ABO entre poblaciones. La incidencia es de alrededor del 0,3-0,8% en la población caucásica, frente al 3-5% en las poblaciones negra o asiática, también con un curso clínico más grave.
Aloinmunización a antígenos de GR fetales o neonatales
El mecanismo más implicado en la EHFRN es la aloinmunización debida al desarrollo de anticuerpos maternos dirigidos a un antígeno presente en la superficie de los glóbulos rojos fetales cuando éstos entran en la circulación sanguínea materna. La producción de anticuerpos maternos contra los antígenos de los glóbulos rojos fetales es provocada por transfusiones previas y por la hemorragia fetomaterna (HFM).
La tasa de aloinmunización en la población general varía entre el 2% y el 7%, con una mayor probabilidad en pacientes transfundidos. Se estima que en el embarazo la tasa oscila entre el 0,4% y el 1,2%.
Después de una transfusión de sangre, entre el 1% y el 2% de las personas desarrollan anticuerpos de grupo sanguíneo; la mayoría tienen pocas consecuencias, pero algunos pueden inducir una forma grave de EHFRN.
La aloinmunización debida a la HFM es un mecanismo inmunomediado adquirido que suele afectar a los embarazos posteriores y no al embarazo en el que se produce la HFM.
Se ha demostrado que el 75% de las mujeres presentan una HFM durante el embarazo o en el momento del parto. En aproximadamente el 50% de estas mujeres, la HFM no supera los 0,1 ml de sangre fetal. Menos del 1% de las mujeres tienen más de 5 mL, y menos del 0,25% tienen más de 30 mL de sangre fetal en su circulación. Algunas situaciones obstétricas aumentan el riesgo de HFM, como la hemorragia preparto, la toxemia del embarazo, la versión externa, la cesárea y la extracción manual de la placenta.
Antígenos e inmunización
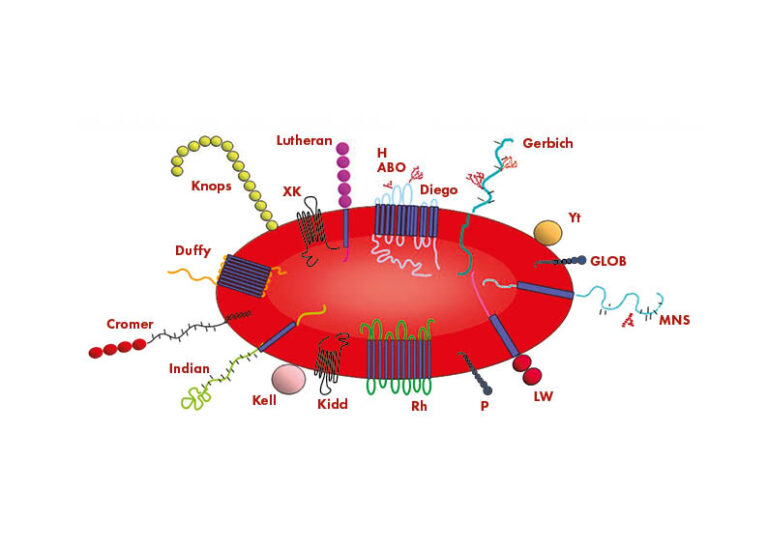
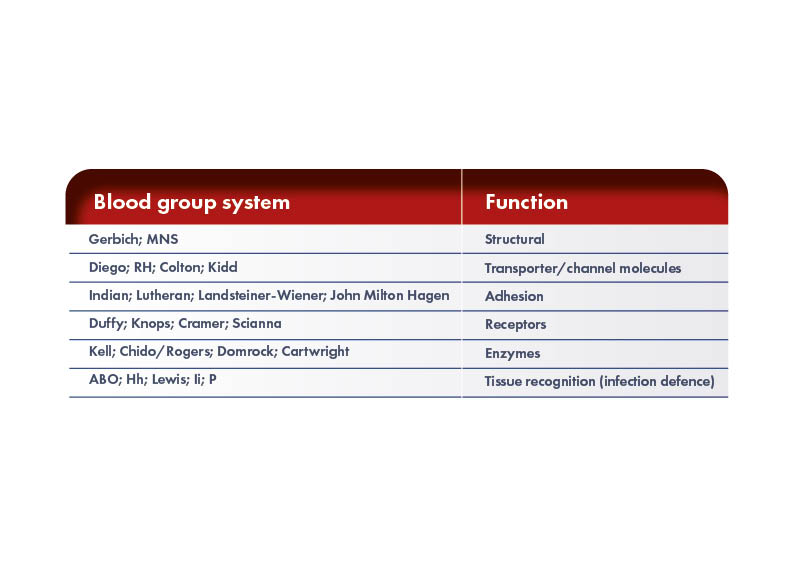
Las personas tienen diferentes antígenos en la superficie de sus glóbulos rojos (GR). Algunos de estos antígenos son responsables del desarrollo de la respuesta inmunitaria que conduce a la EHFRN, mientras que muchos no lo son. La International Society of Blood Transfusion Working Party for Red Cell Immunogenetics and Blood Group Terminology (ISBT WP) reconoce 43 sistemas de grupos sanguíneos que contienen 345 antígenos de glóbulos rojos. Sin embargo, constantemente se descubren nuevos antígenos, por lo que el conocimiento de los posibles complejos antígeno:anticuerpo sigue aumentando. Los antígenos de GR de los diferentes sistemas de grupos sanguíneos son proteínas o glucolípidos, y pueden tener diferentes funciones.
Sistema Rh
Los diferentes antígenos de GR, dentro y entre los diversos sistemas de grupos sanguíneos, tienen un impacto diferente en la producción de anticuerpos, pero sólo una pequeña proporción de estos antígenos causan incompatibilidades de glóbulos rojos clínicamente relevantes. El antígeno de superficie de GR implicado con mayor frecuencia en la forma grave de EHFRN es el factor Rhesus, descubierto en la década de 1940 en monos Rhesus.
El sistema de grupos sanguíneos Rh es el segundo más importante desde el punto de vista clínico después del sistema ABO. Este sistema está formado por 55 antígenos heredados de superficie, de los cuales los principales son los antígenos D, C, c, E y e que están codificados por dos genes altamente homólogos: RHD y RHCE.
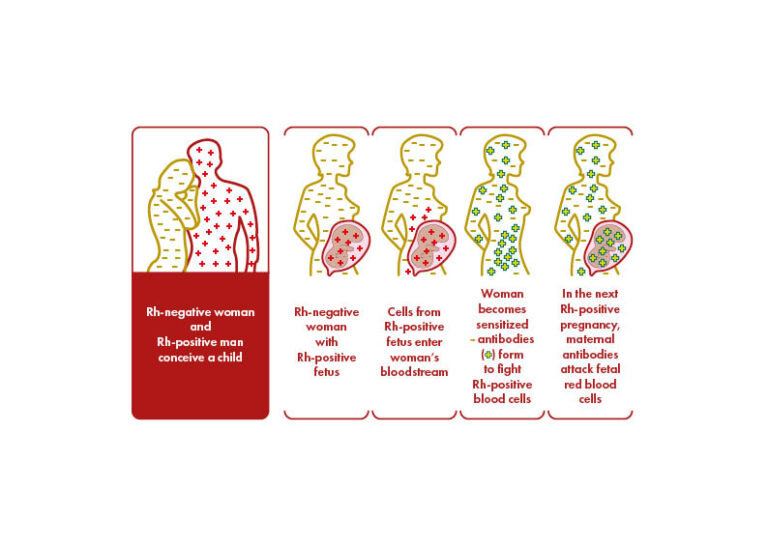
El antígeno más inmunogénico es el antígeno D (RhD). Una persona se considera Rh positivo (RhD+) o Rh negativo (RhD-) en función de la presencia o ausencia del antígeno RhD en la superficie de los glóbulos rojos. Nunca se ha demostrado que exista un antígeno d. Los antígenos se heredan en dos grupos de tres, uno de cada progenitor. Los conjuntos más comunes son CDe(R1), c(d)e(r), y cDE(R2).
Menos del 50% de las personas con Rh positivo son homocigotas para D (es decir, han heredado un conjunto de antígenos que contienen D de ambos progenitores). Si el compañero positivo de una mujer Rh negativo es homocigoto, todos sus hijos serán Rh positivos. Si es heterocigoto, el feto será Rh negativo o Rh positivo con la misma probabilidad. Solo los fetos Rh positivos pueden provocar la inmunización Rh y la producción de anticuerpos anti-D en las mujeres RhD negativas determina la eritroblastosis fetal en los fetos RhD positivos. El antígeno D ya está presente a partir de la sexta/séptima semana de gestación, y 0,1 mL de glóbulos rojos fetales D+ pueden aloinmunizar a una madre Rh negativo. La positividad para RhD varía según las etnias: se registra en el 85% de los caucásicos, en el 95% de los africanos subsaharianos y en más del 99,5% de los asiáticos orientales.
¿Qué antígeno es responsable de los casos más graves de EHFRN?
El antígeno RhD es el más inmunogénico entre los antígenos del sistema Rh, y el anticuerpo anti-D se correlaciona con el mayor riesgo de mortalidad y morbilidad fetal. Los antígenos Rhesus distintos al RhD, incluidos los c, C, E y e, suelen estar implicados, y pueden producir hemólisis grave. Los antígenos de los sistemas de grupos sanguíneos Kell, Duffy, MNS y Kidd también causan formas graves de Enfermedad Hemolítica del Feto y del Recién Nacido.
Comprender las diferentes incompatibilidades de los glóbulos rojos y la producción de anticuerpos que causan la EHFRN es importante para predecir, prevenir, realizar el seguimiento y gestionar los embarazos y neonatos con riesgo de sufrir los efectos de la enfermedad hemolítica del feto y del recién nacido.
Para prevenir la sensibilización Rh y la consecuente anemia hemolítica en el feto, se administra la profilaxis anti-Rh(D) a las mujeres RhD negativas durante y después del embarazo.
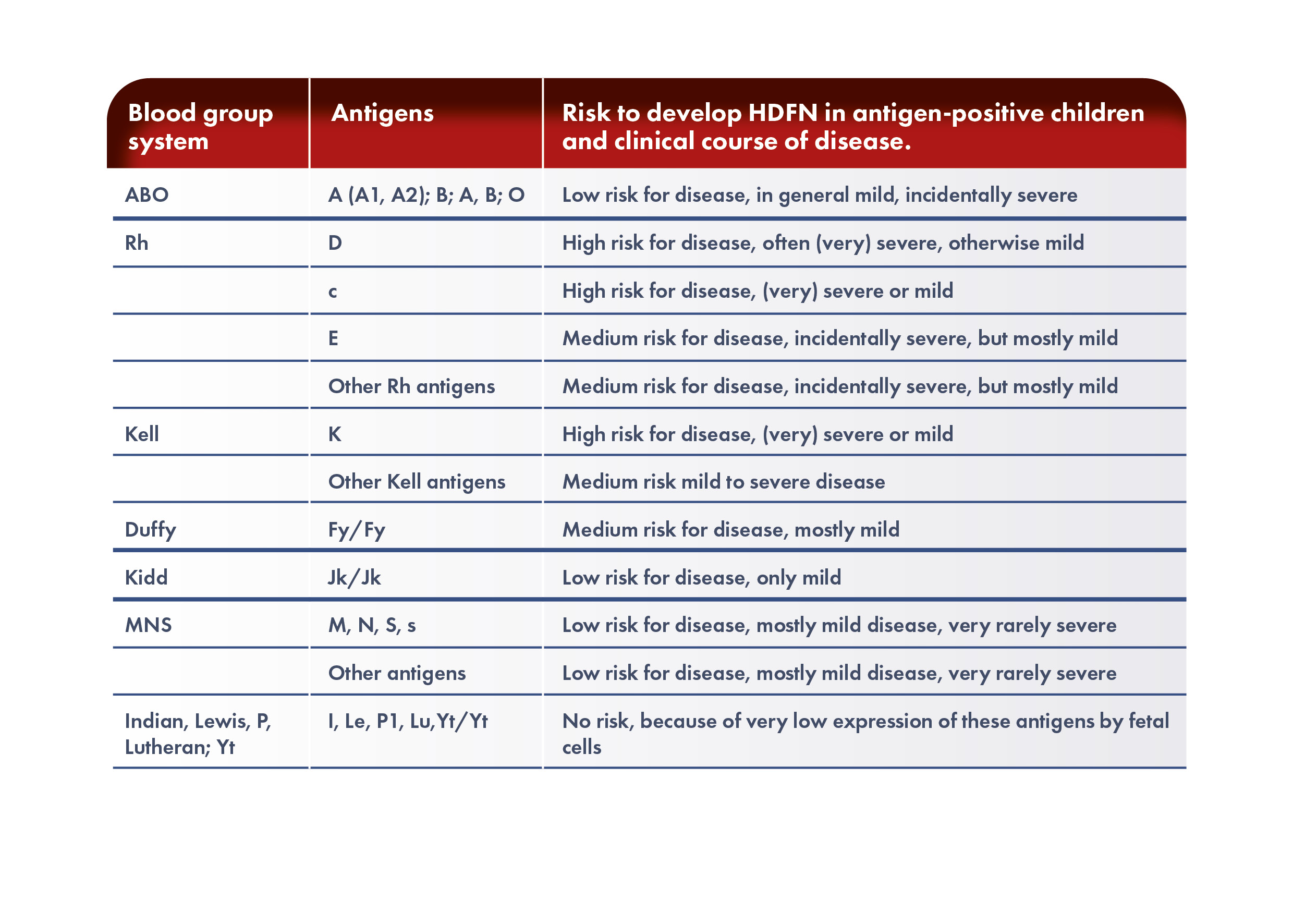
¿Cuál es la fisiopatología de la EHFRN?
La EHFRN se produce cuando el feto o el neonato heredan del padre un antígeno de glóbulos rojos que no está presente en los glóbulos rojos de la madre. Este antígeno no propio provoca la producción materna de anticuerpos específicos. Los anticuerpos IgG maternos atraviesan la placenta y llegan al torrente sanguíneo fetal, se unen al antígeno ajeno y provocan hemólisis y posible anemia. La anemia fetal induce una eritropoyesis compensatoria que puede ser insuficiente, generando una circulación hiperdinámica en el feto que provoca cardiomegalia e insuficiencia hepática. La insuficiencia hepática causa una disminución de los niveles de proteínas y una reducción de la presión oncótica en la circulación, mientras que la insuficiencia cardiaca provoca un aumento de la presión venosa, resultando en edema generalizado y ascitis, conocido como hidropesía fetal, que tiene una elevada tasa de mortalidad perinatal.
La hemólisis de los glóbulos rojos fetales provoca un aumento de los niveles de bilirrubina, que atraviesa la placenta y se elimina a través de la circulación materna durante el embarazo. Tras el nacimiento, el hígado inmaduro del neonato no puede conjugar suficientemente el exceso de bilirrubina, lo que puede llevar a una hiperbilirrubinemia grave y daños irreversibles en el sistema nervioso central, conocido como kernícterus. Esta afección se caracteriza por el depósito de bilirrubina en los ganglios basales y los núcleos del tronco encefálico, correlacionándose con morbilidad a largo plazo, como parálisis cerebral atetoide, problemas de audición y discapacidades psicomotoras.
DIAGNÓSTICO PRENATAL
La enfermedad de Rh suele diagnosticarse durante el cribado prenatal de rutina. La predicción del estado de RhD fetal mediante el cribado prenatal no invasivo del gen RhD fetal (RHD) puede orientar el uso dirigido de la profilaxis prenatal anti-Rh(D).
¿Qué es la EHFRN en el embarazo?
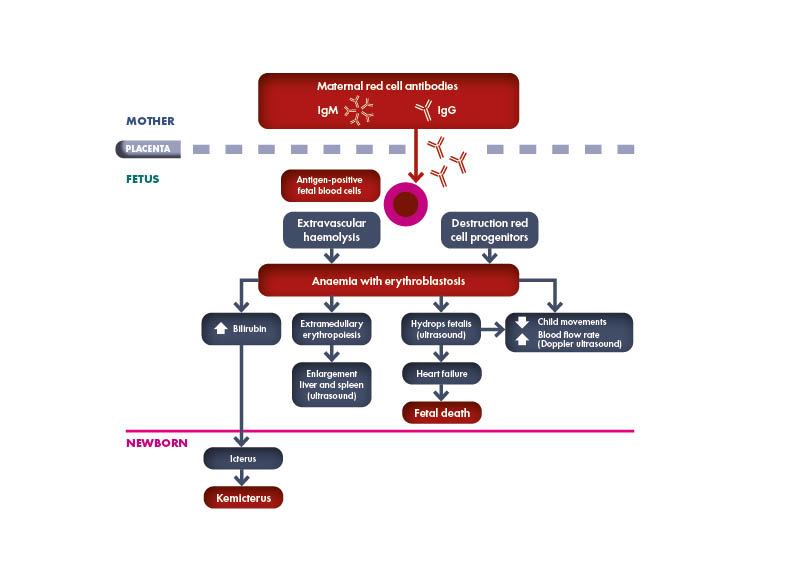
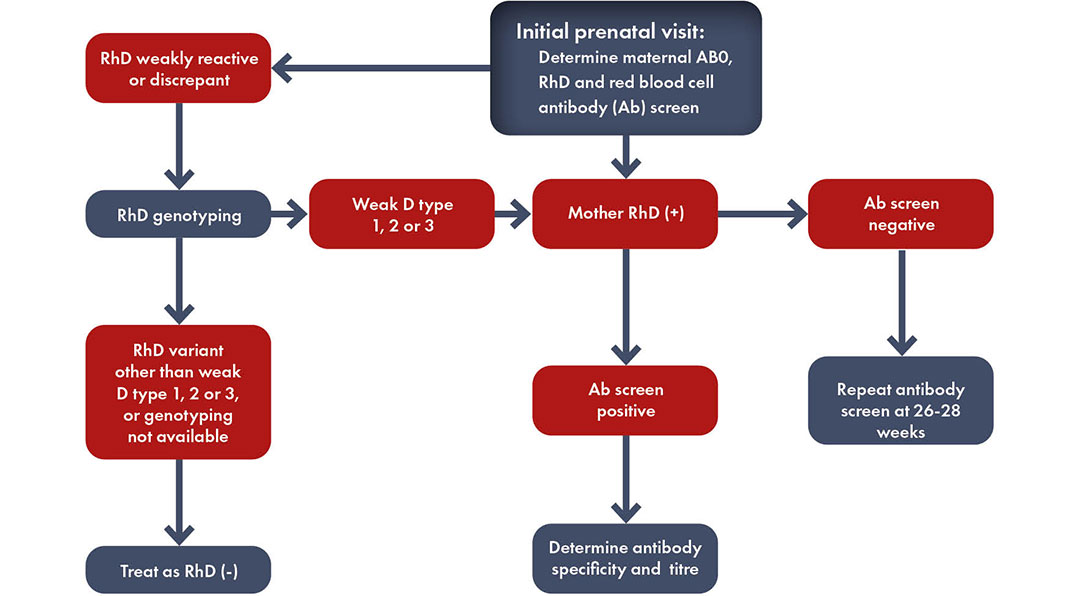
Toda mujer embarazada debe someterse a pruebas de determinación del grupo sanguíneo y de detección de anticuerpos para identificar el estado de Rh y la presencia de una inmunización que suponga un riesgo para el feto de padecer la Enfermedad Hemolítica del Feto y del Recién Nacido (EHFRN), también conocida como eritroblastosis fetal.
Según la Academia Estadounidense de Pediatría (AAP), «si la madre no se ha sometido a una determinación prenatal del grupo sanguíneo o es Rh negativo, se recomienda encarecidamente realizar una prueba directa de anticuerpos (o prueba de Coombs), determinar el grupo sanguíneo y el tipo Rh (D) en la sangre (del cordón umbilical) del bebé».
El grupo sanguíneo y la detección de anticuerpos RBC irregulares deben ser comprobados en la semana 28 de embarazo. Se debe determinar el estado de Rh y ABO del padre del feto de una mujer embarazada con Rh negativo. Si el padre es heterocigoto, el riesgo de sensibilización Rh se reduce a la mitad. Si se conoce el genotipo ABO y Rh del padre, se puede estimar el riesgo de inmunización Rh.
Es importante volver a realizar regularmente la prueba a una mujer embarazada Rh negativo que tenga un compañero Rh positivo. Deben realizarse pruebas adicionales entre las semanas 18 y 20 del embarazo y cada 4 semanas a partir de entonces, teniendo en cuenta que la respuesta inmunitaria inicial rara vez se produce antes de la semana 20 de gestación.

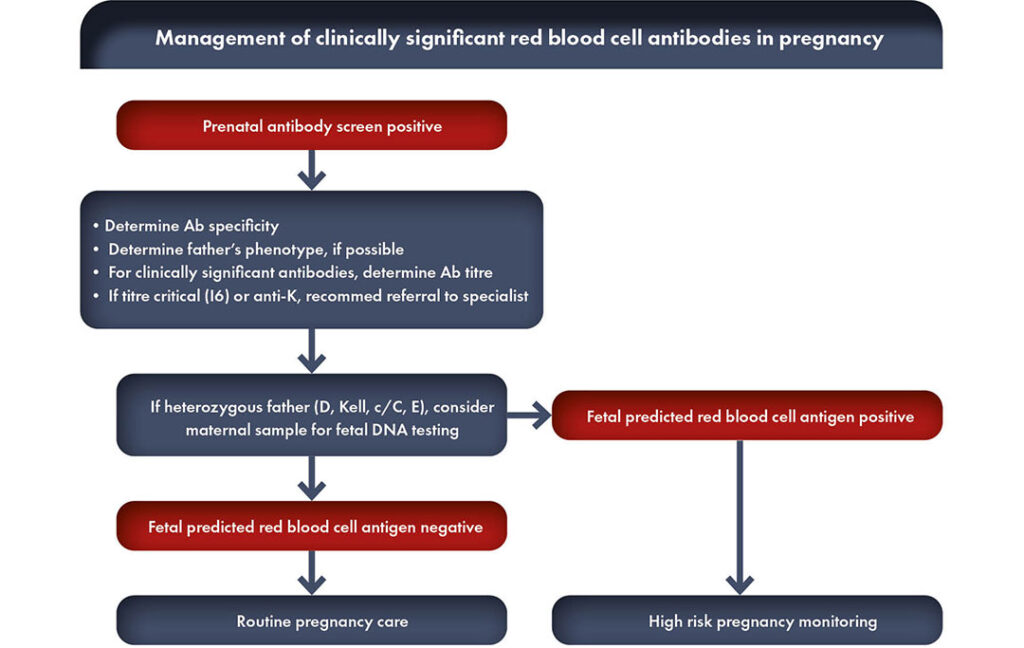
¿Cuáles son los aloanticuerpos eritrocitarios clínicamente significativos?
Cuando no se detecta la presencia o el desarrollo de aloanticuerpos eritrocitarios durante el embarazo, las únicas características clínicas inespecíficas e impredecibles de la EHFRN durante el embarazo son la disminución de los movimientos fetales o la muerte fetal súbita.
Cuando se identifica la presencia de anticuerpos anti-Rh maternos mediante el cribado, la embarazada debe ser controlada mediante pruebas de laboratorio repetidas (títulos de anticuerpos, cuantificación de anticuerpos, citotoxicidad celular dependiente de anticuerpos o CCDA). Si estos exámenes séricos superan un determinado nivel de corte, es necesario realizar investigaciones clínicas en centros especializados, como la ecografía-Doppler, para detectar a tiempo la EHFRN grave que requiera terapia fetal o parto con tratamiento neonatal.
Así pues, un programa de cribado tiene como objetivo identificar aquellos embarazos en los que es necesario el tratamiento intrauterino del feto y/o debe inducirse el parto para disminuir el riesgo de desarrollo de enfermedad hemolítica grave. Sin un programa de cribado, el tratamiento puede retrasarse.
¿Qué pruebas de laboratorio se requieren para el diagnóstico de la EHFRN durante el embarazo?
Dado que el feto puede volverse gravemente anémico a partir de la semana 16 de gestación, la tipificación no invasiva del grupo sanguíneo fetal con ADN fetal libre de células (ADNflc) a partir del plasma materno debe realizarse antes de las 14-15 semanas para el cribado de mujeres RhD negativas no inmunizadas.
Dado que el ADNflc representa sólo una fracción del ADN total libre de células en el plasma materno, se requiere una extracción de ADN altamente eficiente y una tecnología de detección sensible, actualmente con PCR cuantitativa.
Otros métodos aplicados a la tipificación del RHD fetal incluyen la extensión de una sola base seguida de la demostración de los productos específicos mediante GeneScan o espectrómetro de masas.
Recientemente, se ha descrito una PCR digital basada en chip para la tipificación del grupo sanguíneo fetal. Este método se denomina PCR digital de gotas (ddPCR). En una ddPCR, cada gota contiene una sola copia del gen materno o fetal, por lo que la presencia de una copia fetal siempre dará lugar a una señal fuertemente positiva que puede discriminarse fácilmente de las gotas que contienen copias de ADN materno.
Algunos laboratorios utilizan la confirmación de la presencia de ADN fetal con otras secuencias de ADN heredadas paternalmente (por ejemplo, SRY) o un marcador universal de ADN fetal (por ejemplo, RASSF1a metilado) para proporcionar resultados concluyentes en un único ensayo. Puede concluirse que el genotipado fetal no invasivo puede utilizarse de forma fiable para dirigir el seguimiento clínico y de laboratorio a los casos con riesgo de desarrollar EHFRN grave.
Nivel de gravedad de la enfermedad hemolítica
Nivel de gravedad de la enfermedad hemolítica
En las mujeres Rh negativas inmunizadas, es de suma importancia determinar el nivel de gravedad de la eritroblastosis (si la hay) en el feto.
Seis parámetros pueden ayudar a evaluar el nivel de gravedad de la enfermedad hemolítica:
- Antecedentes de la enfermedad
- Títulos de anticuerpos maternos
- Ensayos funcionales de anticuerpos maternos mediados por células
- Mediciones espectrofotométricas del líquido amniótico
- Evaluación ecográfica
- Toma directa de muestras de sangre fetal
- La definición de gravedad es la siguiente:
La «EHFRN muy grave» se refiere a los casos de muerte intrauterina y a los casos tratados mediante transfusiones intrauterinas (TIU) y/o exanguinotransfusión (ET) después del nacimiento.
La «EHFRN grave» también incluye los casos tratados con transfusiones complementarias y los casos en los que es necesario inducir el parto antes de tiempo.
Una «gravedad leve» se define como los casos en los que no es necesario inducir el parto antes de tiempo y en los que basta el tratamiento con fototerapia.
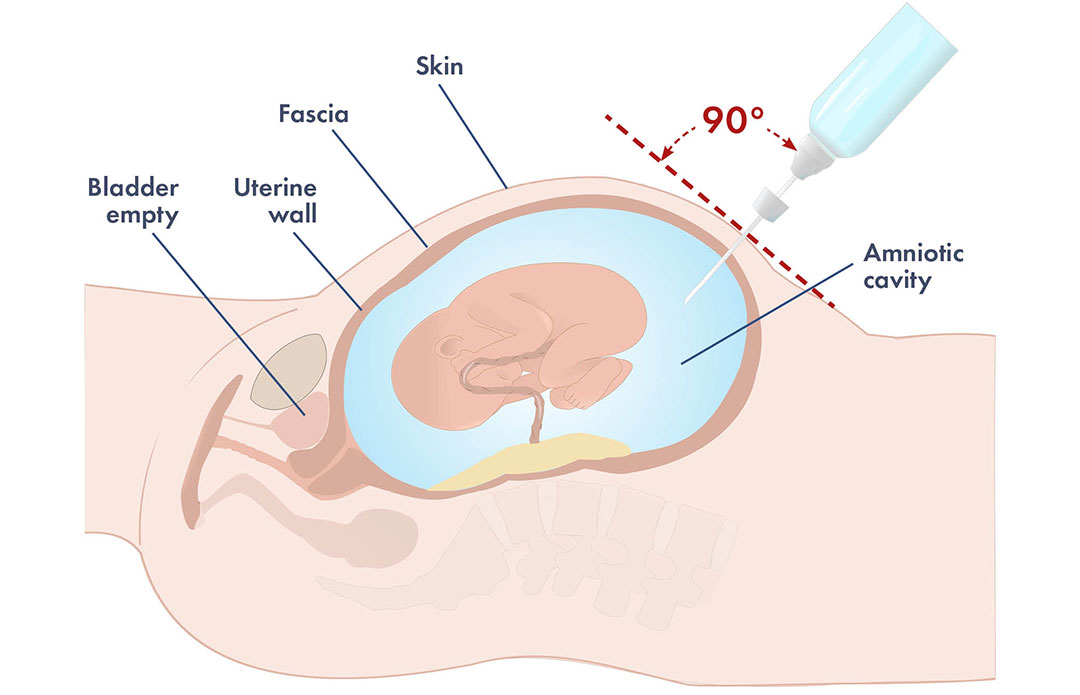
Riesgos de la amniocentesis y de la inducción del parto prematuro
Debe tenerse en cuenta que, debido al riesgo siempre presente de hemorragia fetomaterna (HFM) con el consiguiente aumento de los títulos de anticuerpos y de la gravedad de la hemólisis, la amniocentesis sólo debe realizarse tras una cuidadosa localización ecográfica de la placenta. La amniocentesis realizada sin guía ecográfica se asocia a un riesgo del 10% – 11% de HFM y a una mayor gravedad de la eritroblastosis. Sin embargo, aunque esté guiada por ecografía, la amniocentesis, al ser una maniobra invasiva, puede provocar la HFM. Por lo tanto, sólo debe realizarse si los antecedentes o el título de anticuerpos indican que el feto corre el riesgo de desarrollar hidropesía y morir. Independientemente del título de anticuerpos, la amniocentesis debe realizarse entre las semanas 18 y 19 de gestación en caso de antecedentes de mortinatos previos o si el recién nacido anterior requirió ET tras el nacimiento. En ausencia de tales antecedentes, la amniocentesis sólo debe realizarse si existe un título de anticuerpos que indique un riesgo persistente de hidropesía.
Sólo los fetos que vayan a ser hidrópicos antes de la semana 34 de gestación deben someterse a transfusiones de sangre fetal y sólo estos fetos y los que vayan a ser hidrópicos entre la semana 34 de gestación y el término deben exponerse a los riesgos del parto prematuro inducido. El riesgo de muerte relacionado con un traumatismo fetal por transfusión (intraperitoneal) es del 10 al 15% entre las semanas 22 y 23 del embarazo y desciende al 3-5% después de la semana 28. En el bebé prematuro con eritroblastosis grave, el riesgo de muerte sigue siendo hoy en día significativo en la semana 32 de gestación.
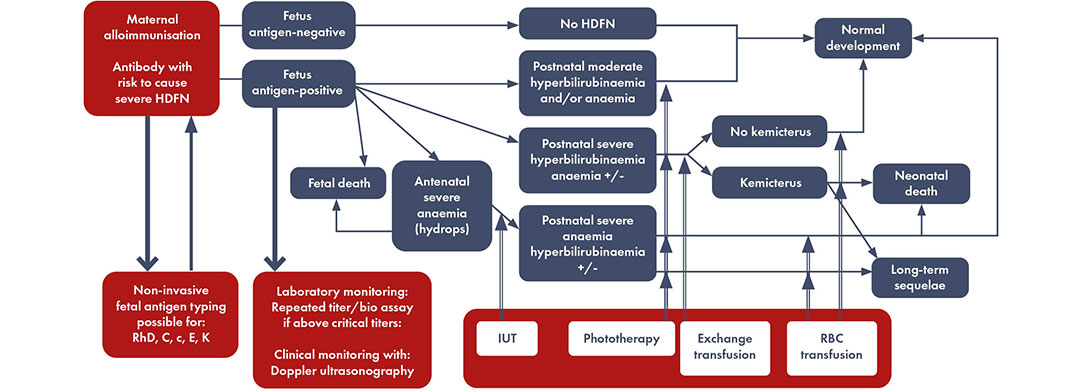
Modelo de enfermedad aloinmunización materna que conduce a la enfermedad hemolítica del feto y del recién nacido y pruebas de laboratorio y posibles pruebas clínicas para discriminar los casos de alto riesgo. Modificado por Haas M et al, 2015.
*Si la tipificación no invasiva de antígeno fetal no está disponible, se debe realizar el seguimiento de los embarazos como si el feto fuera positivo al antígeno cuando el padre biológico es homocigoto o heterocigoto positivo para el antígeno respectivo. El seguimiento de los embarazos puede realizarse como si el feto fuera negativo al antígeno cuando el resultado de la tipificación no invasiva del antígeno fetal es negativo o cuando se sabe con certeza que el padre biológico es homocigoto negativo para el antígeno respectivo.
EVALUACIÓN POSTNATAL
Muchas mujeres tienen poco o ningún rastro de sangre fetal detectable en su circulación durante el embarazo, y solo pequeños volúmenes (<0,1 ml) que pueden aumentar ligeramente en el tercer trimestre. Después del parto, la incidencia y el volumen de la hemorragia fetomaterna (HFM) son generalmente más altos, lo que explica por qué más mujeres se inmunizan con la vacuna D después del parto que durante el embarazo.
Es crucial que todas las mujeres RhD negativo sean evaluadas después del parto para detectar HFM. En caso de resultado positivo, el volumen de la hemorragia fetomaterna debe ser cuantificado. Los volúmenes altos de HFM pueden llevar a la muerte fetal o a una anemia neonatal severa que requiere una transfusión rápida.
Las mujeres RhD negativo deben recibir una dosis adecuada de inmunoglobulina anti-D (Ig anti-D) para destruir todos los glóbulos rojos (GR) fetales en su circulación, con el fin de prevenir la inmunización RhD, la cual presenta riesgos de enfermedad hemolítica del feto y del recién nacido (EHFN) en futuros embarazos RhD positivo. Esta profilaxis anti-Rh(D) es esencial para prevenir la sensibilización al Rh.
¿Cuáles son los hallazgos de la evaluación de la enfermedad hemolítica del feto y del recién nacido?
La enfermedad hemolítica del feto y del recién nacido (EHFN) debe considerarse en el diagnóstico diferencial de recién nacidos con ictericia/hiperbilirrubinemia y, ciertamente, en casos de anemia neonatal. La anemia hemolítica en el feto puede llevar a una eritroblastosis fetal grave.
Al nacer, la conexión con la circulación materna se rompe y, debido al desarrollo inmaduro de la vía metabólica que permite degradar la bilirrubina en el hígado neonatal, el riesgo de hiperbilirrubinemia neonatal aumenta considerablemente. El manejo de la hiperbilirrubinemia es crítico durante el período neonatal debido al riesgo de encefalopatía inducida por bilirrubina.
Para los recién nacidos con una EHFN confirmada, es obligatoria una vigilancia estrecha de los niveles de bilirrubina y hemoglobina para determinar si es necesaria una transfusión de intercambio neonatal para eliminar la bilirrubina y los anticuerpos maternos, y/o si son necesarias transfusiones para reforzar la capacidad de transporte de oxígeno a los tejidos. Los infantes deben ser vigilados atentamente para detectar los signos clínicos de una anemia en curso, que se manifiestan más comúnmente por una mala alimentación, la actividad más aeróbica para los recién nacidos. También se puede observar un aumento del sueño a medida que la anemia se agrava.
En caso de anemia en curso, la producción de reticulocitos en la médula ósea fetal puede disminuir y otras líneas celulares, como los neutrófilos, pueden verse afectadas. Una vigilancia semanal de los reticulocitos y del hematocrito permitirá guiar la toma de decisiones sobre la transfusión y tranquilizar cuando la médula se recupere.
BIBLIOTECA
Fue en 1968 cuando se aprobó la inmunoglobulina anti-Rh(D) para prevenir la aparición de sensibilización Rh al antígeno del grupo sanguíneo Rh(D) tras el parto en mujeres Rh negativas.
Posteriormente, la profilaxis anti-Rh(D) se amplió para incluir a las embarazadas Rh negativas en casos de aborto espontáneo, embarazo ectópico, amniocentesis, hemorragia o traumatismo abdominal durante el embarazo y/o versión cefálica externa para presentación podálica.
Aunque este enfoque es muy eficaz para prevenir la enfermedad de Rh, datos recientes han demostrado que en aproximadamente el 50% de los casos que reúnen los requisitos en todo el mundo no se administra inmunoglobulina anti-Rh(D).
El suministro insuficiente, las consideraciones de coste, la ignorancia, la falta de acceso al producto inmunizante y el uso de productos cuya eficacia terapéutica no ha sido probada son las principales razones de esta cobertura preventiva insatisfactoria. Hay que subrayar que la enfermedad de Rh sigue siendo la causa de más de 160,000 muertes perinatales y 100,000 casos de discapacidad al año. Estos preocupantes datos representan sólo una reducción del 50% en relación con la época anterior a la administración de inmunoglobulina, una situación que teniendo en cuenta la elevada carga de una enfermedad prevenible, debería considerarse inaceptable.
La Federación Internacional de Ginecología y Obstetricia (FIGO) y la Confederación Internacional de Matronas (IMC) publicaron en 2021 un documento conjunto de directrices sobre la prevención de la enfermedad de Rh mediante inmunoprofilaxis que se resumirá brevemente en esta sección.
FIGO E IMC
La Federación Internacional de Ginecología y Obstetricia (FIGO) y la Confederación Internacional de Matronas (IMC) publicaron en 2021 un documento conjunto de directrices sobre la prevención de la enfermedad de Rh mediante inmunoprofilaxis que se resumirá brevemente en las siguientes secciones.
Grupo sanguíneo y tipificación de Rh(D)
El conocimiento a priori del estado de Rh materno es obligatorio para prevenir la sensibilización Rh. La tipificación de Rh(D) debe realizarse preferentemente en el primer trimestre del embarazo ya que las indicaciones de inmunoprofilaxis anti-Rh(D) pueden surgir precozmente durante la gestación.
Administración posparto de inmunoglobulina anti-Rh(D)
La sensibilización Rh(D) se produce en el 16% de los embarazos de mujeres Rh(D)-negativas y la administración de inmunoglobulina Rh(D) reduce este riesgo al 15%. Por lo tanto, esta intervención debería representar la máxima prioridad en los países/regiones donde la profilaxis es actualmente inadecuada o no se proporciona. Debe administrarse una dosis de 1,500 UI (o de forma equivalente 300 μg) de anti-Rh(D) por vía intramuscular dentro de las 72 horas siguientes al parto en mujeres Rh negativas que den a luz a un niño Rh positivo.
Administración de inmunoglobulina anti-Rh(D) durante el embarazo
El parto desempeña un papel crucial en muchos casos de sensibilización Rh(D). Por lo tanto, la inmunoprofilaxis durante el embarazo tiene una importancia fundamental. La administración prenatal de inmunoglobulina anti-Rh(D) puede realizarse por vía intramuscular o intravenosa. Puede administrarse una vez (1,500 UI) a las 28-34 semanas de gestación o dos veces a las 28 y 32-34 semanas de gestación (625 UI o 1,500 UI en ambas edades gestacionales).
Aborto espontáneo
La inmunoprofilaxis sólo debe administrarse a mujeres con un aborto espontáneo o de gestión médica después de 10 semanas de gestación. En caso de gestión quirúrgica del aborto espontáneo se sugiere que la profilaxis se considere también antes de las 10 semanas de gestación.
Embarazo ectópico
Se recomienda encarecidamente la administración de inmunoglobulina anti-Rh(D) en caso de embarazo ectópico ya que se ha demostrado que un embarazo tubárico roto se asocia a una incidencia del 24% de aloinmunización al Rh(D).
Toma de muestras de vellosidades coriónicas (MVC) o amniocentesis
En la mayoría de los países, aunque no en todos, se sugiere administrar inmunoglobulina anti-Rh(D) a las embarazadas Rh(D)-negativas después de la MVC o amniocentesis.
Hemorragias y traumatismos abdominales en el embarazo
Se aconseja la inmunoprofilaxis con la administración de inmunoglobulina anti-Rh(D) en caso de traumatismo abdominal sobre la base de que esta afección puede provocar una transfusión feto-materna y en consecuencia un aumento del riesgo de aloinmunización Rh(D). La dosis de inmunoglobulina anti-Rh(D) más comúnmente administrada es de 1500 UI.
Muerte fetal intrauterina
Dado que la muerte intrauterina de un feto puede ser el resultado de una hemorragia fetomaterna (HFM) conspicua, la cantidad de hemorragia debe determinarse con una prueba adecuada como el test de Kleihauer-Betke para determinar la dosis correcta de inmunoglobulina anti-D necesaria.
Versión cefálica externa en caso de presentación podálica
El procedimiento de versión cefálica externa tiene un riesgo de HFM que oscila entre el 2 y el 6%. Por lo tanto, se aconseja administrar inmunoprofilaxis con inmunoglobulina anti-Rh(D) a las 32 semanas de gestación.
¿Qué es la prueba no invasiva de ADN de RhD fetal?
El estado de Rh(D) del feto puede determinarse mediante una prueba prenatal no invasiva de ADN libre de células realizada en el primer trimestre del embarazo. Los responsables de las políticas sanitarias deberían incluir esta prueba no invasiva como una opción futura para combatir la enfermedad de Rh.
¿Cuántas dosis de inyección anti-D necesito?
La dosis de inmunoglobulina anti-Rh(D) que debe administrarse a una embarazada Rh negativa varía en función de las distintas afecciones.
Prioridad alta
Determinar el factor Rh materno preferiblemente al principio del embarazo. Para las mujeres Rh(D)-negativas, determinar el factor Rh del recién nacido a partir de la sangre del cordón umbilical. Administrar inmunoglobulina anti-Rh(D) dentro de las 72 horas siguientes al parto a las mujeres con un recién nacido Rh(D)-positivo a menos que ya estén sensibilizadas. Utilizar una dosis de 500 UI (100 µg) de inmunoglobulina anti-Rh(D); si es asequible y hay un suministro suficiente, pueden administrarse 1500 UI (300 µg) como es habitual en los países de ingresos altos. La vía intramuscular es tan eficaz como la intravenosa.
Prioridad media
Profilaxis anti-Rh(D) de rutina durante el embarazo: 1500 UI (300 µg) a las 28-34 semanas. Profilaxis con inmunoglobulina anti-Rh(D) (500 UI; 100 µg) tras un aborto quirúrgico o un embarazo ectópico (todas las edades gestacionales) o tras un aborto espontáneo o médico/aborto natural después de 10 semanas. Profilaxis anti-Rh(D) tras hemorragia, traumatismo abdominal durante el embarazo y/o muerte fetal (500 o 1500 UI; 100 o 300 µg) durante el segundo o tercer trimestre. Se puede utilizar el test de Kleihauer-Betke para calcular la dosis óptima.
Prioridad baja
Profilaxis anti-Rh(D) tras amniocentesis, toma de muestras de vellosidades coriónicas o versión cefálica externa (500 UI; 100 µg).

