مقدمة
تهدف RhD Education إلى مساعدة أطباء التوليد وأمراض النساء والقابلات والأطباء المهتمين بمشاكل تحصينات فصيلة الدم والنساء على مواكبة المشكلات الناجمة عن عدم توافق فصائل الدم المختلفة بين الوالدين والتي لها بعد ذلك تداعيات على نمو وعافية وصحة طفلهما في المستقبل. على وجه الخصوص، على الرغم من أن مشكلة عدم توافق عامل Rh معروفة منذ ما يقرب من مائة عام وأن الوقاية، التي يتم تنفيذها من خلال الوقاية المناعية، قد تم استحداثها منذ أكثر من خمسين عامًا، إلا أن هذه المشكلة لا تزال تؤثر في حوالي 50% من حالات الحمل في جميع أنحاء العالم والتي تتسم بما يترتب على ذلك من وفيات في الفترة المحيطة بالولادة و/أو حالات مرضية و/أو مشكلات خطيرة بعد الولادة.
تؤكد الإرشادات الأخيرة التي روج لها الاتحاد الدولي لأمراض النساء والتوليد (FIGO) والاتحاد الدولي للقابلات (ICM) المنشورة في نهاية عام 2021 أن الاستراتيجيات الرئيسية هي العودة إلى استرعاء تركيز انتباه الأطباء والنساء على هذه المشكلة، واستحداث النمط الروتيني لفصائل الدم لدى النساء في سن الإنجاب أو في بداية الحمل إذا لم يكن ذلك مطبقًا بعد، والاستثمار في الاستخدام غير المقيد للغلوبولين المناعي كأولوية للصحة العامة في جميع دول العالم. وهذه هي أيضًا الأهداف التي حددها اتحاد تم إنشاؤه في نيويورك بجامعة كولومبيا في عام 2018 ويسمى WIRhE (المبادرة العالمية للقضاء على مرض Rh)، من خلال إنشاء أكاديمية دولية للمستشارين الذين لا يساهمون فقط في هذا الموقع الإلكتروني ولكنهم سيساعدون على إبقاء Rh Educational محدثة ومثيرة للاهتمام. ويمثل هؤلاء المستشارون أيضًا، في العديد من مناطق العالم، سفراء لتنفيذ الاستراتيجيات المذكورة أعلاه. وتضمن أكاديمية WIRhE الجودة والطبيعة العلمية لمحتويات RhD Education التي كتبها خبراء وتستند إلى أحدث الدراسات العلمية السابقة.
الأمور الواجب معرفتها عن انحلال الدَّم الوليدي (HDFN)
ما الطريقة التي تهاجم بها الأجسام المضادة القادمة من الأم الجنين في داء انحلال الدم في الجنين والأطفال حديثي الولادة (HDFN)؟
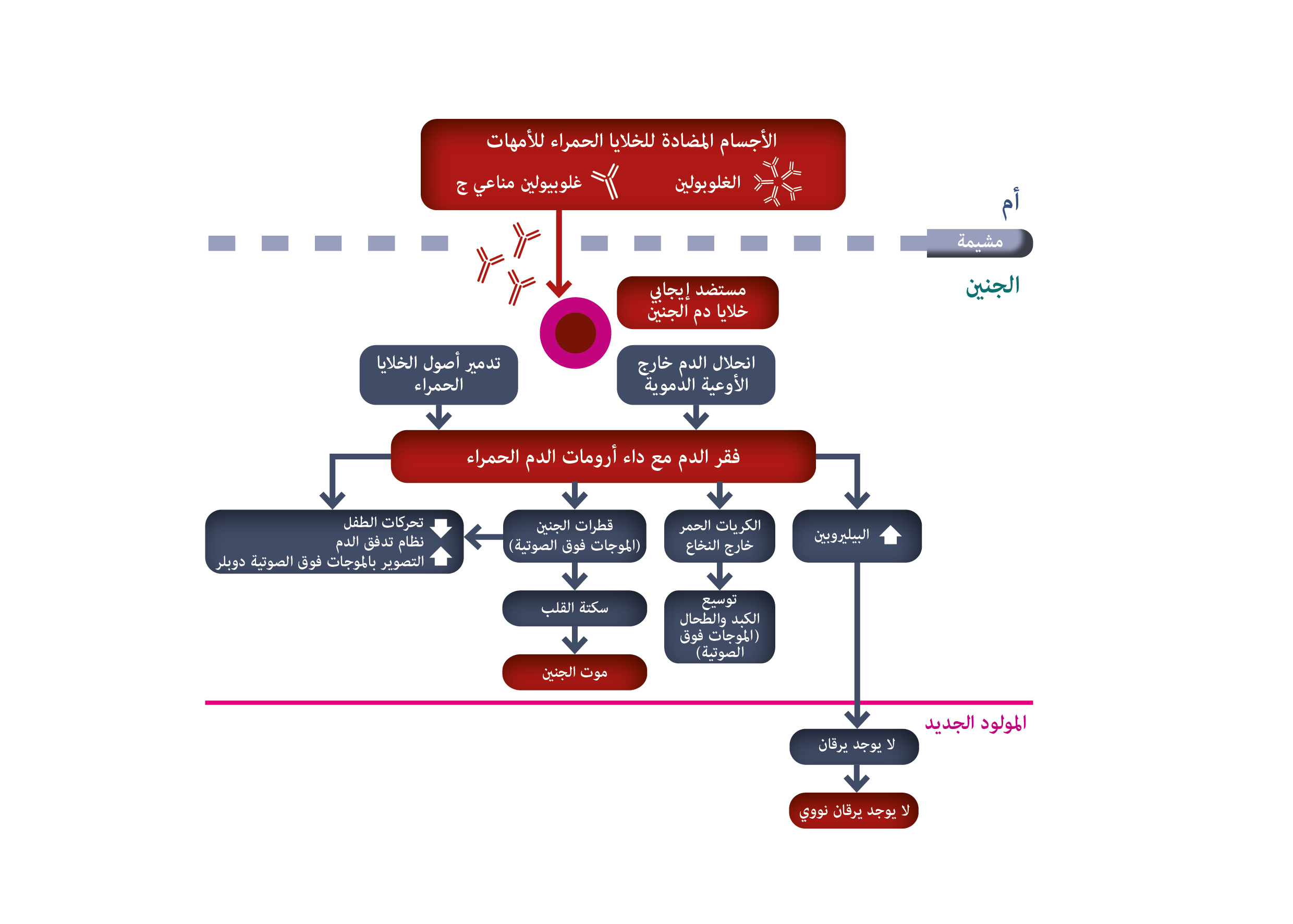
داء انحلال الدم في الجنين والأطفال حديثي الولادة (HDFN) اضطراب ناتج عن الهجوم بواسطة الجهاز المناعي الحساس للأم من خلال أجسام مضادة محددة تستهدف مستضدات فصيلة الدم على سطح خلايا الدم الحمراء الجنينية أو حديثي الولادة (RBC)، والتي يوجد بها عجز على سطح كرات الدم الحمراء للأمهات. يمكن أن ينتج عن الإصابة بداء انحلال الدم في الجنين والأطفال حديثي الولادة (HDFN) عواقب مرضية تتراوح من فقر الدم الانحلالي (الخفيف إلى الشديد) والاستسقاء الجنيني في الجنين وفرط بيليروبين الدم الوليدي الشديد واليرقان عند الأطفال حديثي الولادة، وهي حالات يمكن أن تؤدي إلى الاعتلال والوفيات بنسبة كبيرة.
- كيف يرتبط داء انحلال الدم في الجنين والأطفال حديثي الولادة (HDFN) بعامل Rh؟
- علم الأوبئة
- كيف يمكن الوقاية من مرض انحلال الدم Rh؟
- أنواع HDFN
- عدم توافق AB0
- المناعة المتباينة لمستضدات كرات الدم الحمراء للجنين أو حديثي الولادة
- نظام Rh
- ما المقصود يالمستضد المسؤول عن أشد حالات HDFN؟
- ما المقصود بالفيزيولوجيا المرضية لـHDFN؟
كيف يرتبط داء انحلال الدم في الجنين والأطفال حديثي الولادة (HDFN) بعامل Rh؟
المستضد الأكثر شيوعًا المشارك في آلية المناعة المتباينة هذه بسبب عدم توافق المستضدات هو مستضد الريسوس D (RhD)، إلا أنه في عام 1932، عثر الدكتور لويس ك. دايموند على عدد متزايد باستمرار من المستضدات المختلفة التي يحتمل أن تشارك في التسبب في الاضطراب منذ الوصف الأول للمرض. عندما كتب عن داء كرات الدم الحمراء الجنينية عند الأطفال حديثي الولادة بناءً على مسحات محيطية. هذا وتعترف كل من مجموعة عمل الجمعية الدولية لنقل الدم لعلم الوراثة المناعية للخلايا الحمراء ومصطلحات فصيلة الدم (ISBT WP) بـ43 نظاما لفصائل الدم تحتوي على 345 مستضدًا للخلايا الحمراء حاليًا.
علم الأوبئة
لعدم توافق Rh توزيع عالمي يختلف في مناطق جغرافية مختلفة حسب العرق والسلالة وعوامل الخطر. تعد فصيلة الدم ذات عامل Rh السلبي هي الأكثر شيوعًا في الأجناس البيضاء (15%) مقارنة بالأمريكيين من أصل أفريقي (5% إلى 8%) أو الآسيويين والأمريكيين الأصليين (1% إلى 2%). ويعني هذا أن المرأة البيضاء السلبية Rh لديها فرصة بنسبة 85% للتزاوج مع رجل إيجابي Rh.
يزيد عدم توافق Rh الذي يحدث بشكل متكرر من خطر الإصابة بـ HDFN مع أي حدث نزيف جنيني أمومي (FMH). يجب التأكيد على أن كمية 0.1 مل فقط من دم الجنين التي تدخل الدورة الدموية للأم كافية لإحداث المناعة المتباينة.
كيف يمكن الوقاية من مرض انحلال الدم Rh؟
بفضل الوقاية من هذا المرض والكشف المبكر عنه وإدارته نظرًا للتحسينات في فهم الفيزيولوجيا المرضية وفي الموارد الدوائية، انخفض معدل حدوث وانتشار HDFN بشكل كبير في السنوات الـ50 الماضية.
تم استحداث الوقاية المناعية Rhesus D السلبية (RhD) لأول مرة في عام 1968، ما سمح بانخفاض في حدوث الإصابة بداء HDFN من 1% من جميع الأطفال حديثي الولادة في جميع أنحاء العالم (مع ما يقرب من 50% من الوفيات) إلى 0.5%. انخفض معدل الإصابة بـ HDFN إلى 0.1% مع إعطاء الوقاية المناعية Rh(D) قبل الولادة.
إن الجمع بين الوقاية المناعية قبل الولادة وبعدها فعال بنسبة 99% تقريبًا في منع حساسية الأمهات تجاه Rh(D).
لذلك، توصي معظم الإرشادات الحالية التي أعدتها جمعيات مختلفة من المتخصصين في الرعاية الصحية المعنيين بالوقاية من HDFN وفي التعامل معه بالوقاية المناعية باستخدام IgG anti-Rh(D) لكل امرأة سلبية غير حساسة لـ Rh(D)، مع مراعاة توقيت مختلف حسب الحالة:
(1) في الأسبوع 28 من الحمل خلال كل حمل
(2) مباشرة بعد ولادة كل طفل حديث الولادة إيجابي لـ Rh(D)
(3) في سياق أي حدث آخر يمكن أن يعرض الأم لمستضد Rh(D) (مثل الإجهاض والإجهاض التلقائي وإصابة البطن)
ومع ذلك، بناء على العدد السنوي لجرعات مضادات Rh(D) المنتجة والمتوفرة في جميع أنحاء العالم، فقد قدر أن ما يقرب من 50% من النساء في جميع أنحاء العالم اللائي يحتجن إلى هذا النوع من الوقاية المناعية لا يتلقينه، ويرجع ذلك على الأرجح إلى نقص الوعي والتوفر و/أو القدرة على تحمل التكاليف، مما يعرض مئات الآلاف من الأجنة وحديثي الولادة لخطر الإصابة بمرض Rh كل عام.
والفجوة بين العرض والطلب على الغلوبولين المناعي G المضاد للعامل الريسوسي (D) أكبر في البلدان منخفضة الدخل، مثل مناطق جنوب آسيا وجنوب الصحراء الكبرى، وبلدان شرق وجنوب شرق آسيا والمحيط الهادئ، وبلدان أوروبا الشرقية/آسيا الوسطى، وبلدان أمريكا اللاتينية ومنطقة البحر الكاريبي، وبلدان شمال أفريقيا/الشرق الأوسط، ولكن أيضًا في البلدان مرتفعة الدخل، تقل الوقاية المناعية لتوعية الأمهات بالعامل الريسوسي (D) عن المستوى الأمثل المطلوب لضمان الوقاية الكاملة.
ويلزم بذل المزيد من الجهود للتغلب على هذه الحالة التي ما زالت منتشرة الآن، بدءًا من زيادة الوعي بالمرض ووسائل الوقاية منه وعلاجه.
ينهض الموقع الإلكتروني بتلك الرسالة المحددة.
أنواع HDFN
مرض انحلال الدم للجنين والوليد (HDFN)، المعروف أيضًا باسم جنين أرومة الدم الحمراء، اضطراب مناعي تهاجم فيه الأجسام المضادة للأمهات خلايا الدم الحمراء الجنينية أو الوليدة (RBCs) بسبب عدم توافق المستضد، مع انحلال الدم في الدورة الدموية للجنين أو حديثي الولادة.
يمكن أن يسبب هذا المرض حالات مرضية ووفيات كبيرة، خاصة في البيئات التي تتسم فيها موارد الرعاية الصحية بأنها محدودة.
تتمثل الآليات التي يتم من خلالها تطوير الأجسام المضادة للأمهات ومهاجمة مستضدات كرات الدم الحمراء الجنينية أو حديثي الولادة بشكل أساسي من خلال عدم توافق ABO والمناعة المتباينة بسبب حساسية الأم للمستضدات السطحية لكرات الدم الحمراء الجنينية أو حديثي الولادة عن طريق نقل الدم ونزيف الجنين الأمومي (FMH) في أثناء الحمل أو في وقت الولادة.
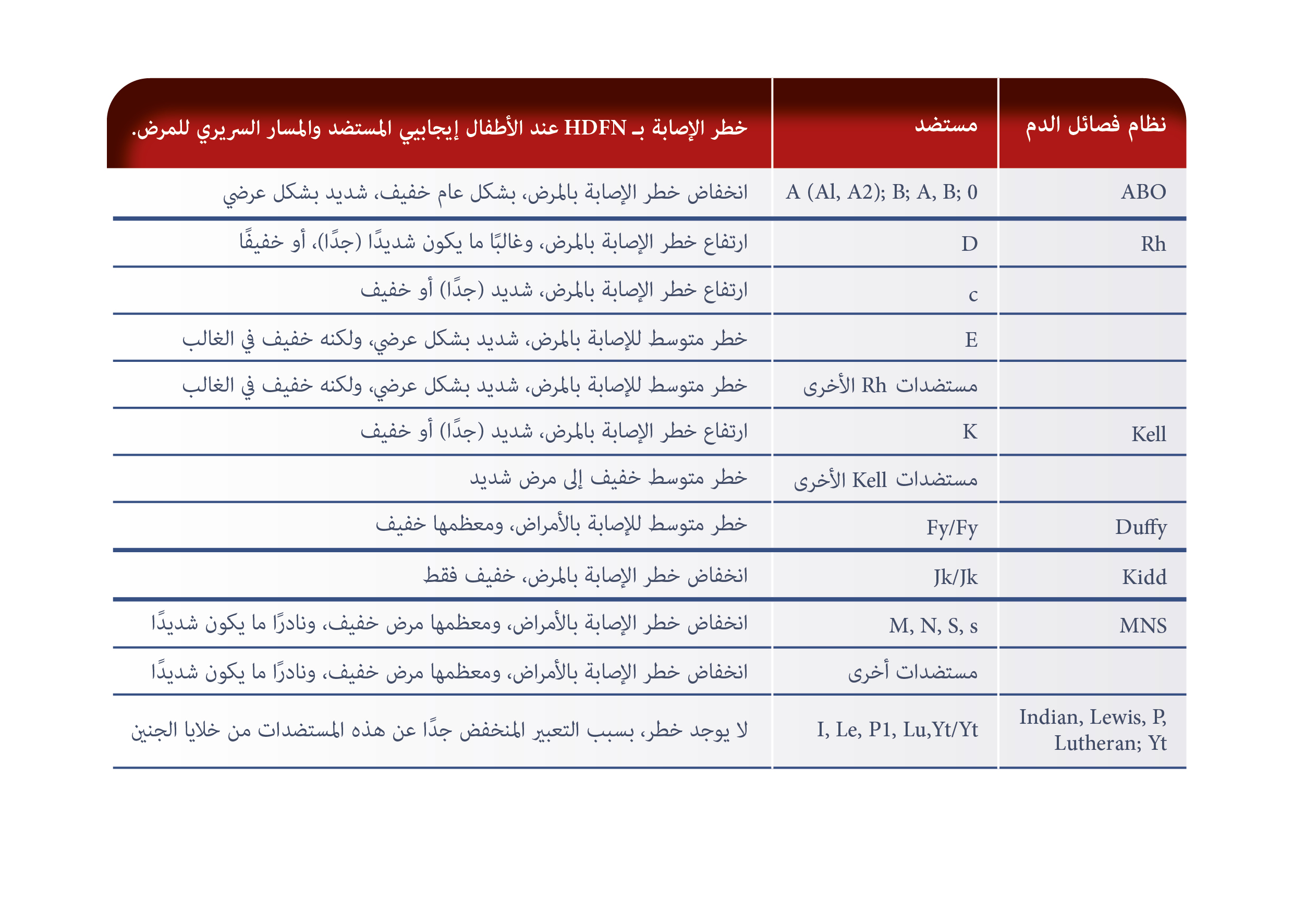
يتم تصنيف أنواع مختلفة من HDFN التي يثير بها المستضد الخيفي الاستجابة. تشمل الأنواع ABO، وanti-RhD، وanti-RhE، وanti-Rhc، وanti-Rhe، وanti-RhC، ومجموعات متعددة المستضدات، وanti-Kell.
عدم توافق AB0
عدم توافق ABO هو عدم تطابق خلقي بين فصيلة دم الأم والجنين، والذي يحدث في 15 إلى 20% من حالات الحمل. إن عدم التوافق بين مستضدات دم الأم والجنين في نظام ABO هو السبب الرئيسي لليرقان عند حديثي الولادة والشكل الأكثر شيوعا من HDFN، لكن HDFN الحاد السريري لن يتطور إلا في حوالي 1% من حالات عدم تطابق فصائل الدم.
يمكن حسبان أن المرض الأكثر اعتدالاً بشكل عام الناجم عن عدم توافق ABO يرجع إلى التعبير عن مستضدات A وB بواسطة المشيمة والأنسجة الأخرى، وبالتالي قد ترتبط هذه المستضدات بالأجسام المضادة للأمهات إلى حد ما. علاوة على ذلك، لم يتم تطوير التعبير عن مستضدات فصيلة الدم A وB على خلايا الدم الحمراء الجنينية بشكل كامل، وبالتالي هناك عدد أقل من مواقع المستضدات على سطح كرات الدم الحمراء الجنينية لترتبط بها الأجسام المضادة.
يجب أن نتذكر أن الأفراد يبدأون بشكل طبيعي في تكوين أجسام مضادة A و/أو B للمستضدات التي لا يمتلكونها عند بلوغهم حوالي 3-6 أشهر من العمر. نتيجة لذلك، يمكن أن يحدث ABO HDFN مع الحمل الأول دون أي تعرض سابق للمستضد الأجنبي، على عكس الأنواع الأخرى من HDFN، ويلاحظ ذلك بشكل حصري تقريبًا في الأمهات المصابات بفصيلة الدم O وهو أكثر شيوعا مع فصيلة دم الجنين.
الأمهات ذات فصيلة الدم O لديها بشكل طبيعي الغلوبولين المناعي من فئة G (IgG) مقارنة بفصائل الدم A أو B، وهي قادرة على عبور المشيمة. وفي أثناء الحمل، يمكن زيادة تكوين المسميات المضادة لـA وB وAnti-A وB من فئة IgG بشدة.
يطور كل من مرضى المجموعتين A وB أيضًا الأجسام المضادة الخاصة بالمستضدات التي لا يمتلكونها، ومع ذلك فهم ليسوا عادة معرضين لخطر HDFN لأن هذه الأجسام المضادة تكون دائمًا تقريبا من فئة IgM وبالتالي لا يمكن أن تسبب أمراض الجنين أو أمراض حديثي الولادة لأنها لا تعبر المشيمة.
في حالات نادرة جدًا، كان عدم توافق ABO مما ذكر كسبب لفقر الدم الجنيني الوخيم والحالات المرضية في الفترة المحيطة بالولادة. هناك فرق لافت للنظر، ولكن غير مفهوم، في حدوث HDFN باستخدام ABO بين السكان. يبلغ معدل الإصابة حوالي 0.3-0.8% في سكان القوقاز، مقابل 3-5% في السكان السود أو الآسيويين، أيضًا مع مسار سريري أكثر حدة.
المناعة المتباينة لمستضدات كرات الدم الحمراء للجنين أو حديثي الولادة
الآلية الأكثر مشاركة في HDFN هي المناعة المتباينة بسبب تطوير الأجسام المضادة للأمهات التي تستهدف مستضدًا موجودًا على سطح كرات الدم الحمراء الجنينية، وذلك عندما تدخل كرات الدم الحمراء الجنينية إلى الدورة الدموية للأم. يتم استنباط إنتاج الأجسام المضادة للأمهات ضد مستضدات كرات الدم الحمراء الجنينية من خلال عمليات نقل الدم السابقة وFMH.
يتراوح معدل المناعة المتباينة في عموم السكان من 2% إلى 7%، مع زيادة احتمال الإصابة بالمرضى الذين تم نقلهم. في الحمل، يقدر المعدل في حدود 0.4% إلى 1.2%.
بعد نقل الدم، يطور 1% إلى 2% من الأشخاص أجسامًا مضادة لفصيلة الدم؛ ومعظمها ذو عواقب قليلة، ولكن بعضها يمكن أن يحفز شكلاً حادًا من HFDN.
المناعة المتباينة بسبب FMH هي آلية مكتسبة بواسطة المناعة وتؤثر عادة على حالات الحمل اللاحقة بدلاً من الحمل الذي يحدث فيه FMH.
وقد تبين أن 75% من النساء لديهن FMH في أثناء الحمل أو في وقت الولادة. في حوالي 50% من هؤلاء النساء، لا يتجاوز FMH 0.1 مل من دم الجنين. أقل من 1% من النساء لديهن أكثر من 5 مل، وأقل من 0.25% لديهن أكثر من 30 مل من دم الجنين في دوراتهن. تزيد بعض حالات الولادة من خطر الإصابة ب FMH، بما في ذلك نزيف ما قبل الولادة، وتسمم الدم أثناء الحمل، والتحويل الخارجي، والعملية القيصرية، والإزالة اليدوية للمشيمة.
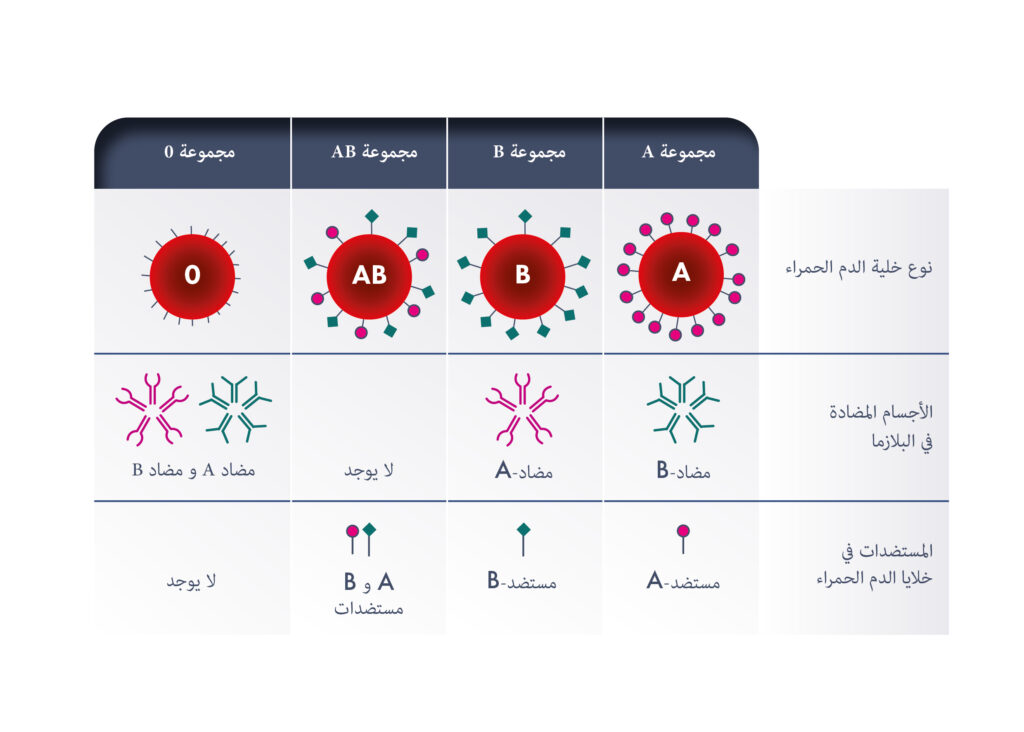
المستضدات والمناعة
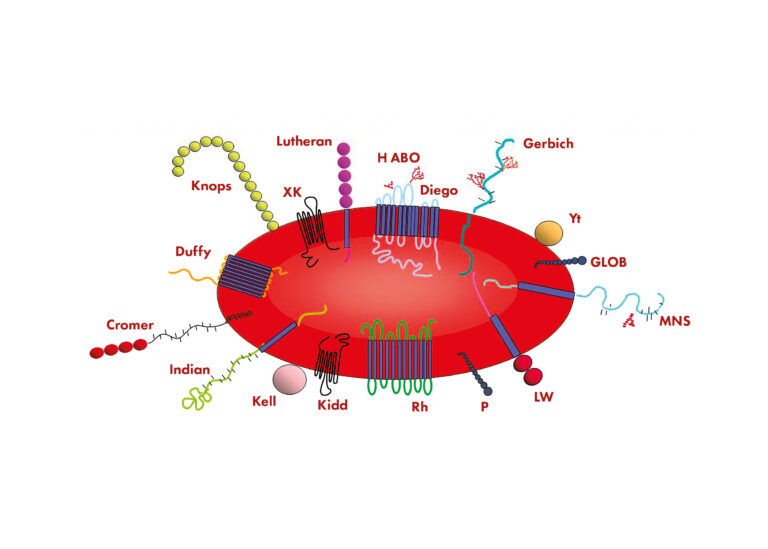
يوجد لدى الأفراد مستضدات مختلفة على سطح كرات الدم الحمراء. وبعض هذه المستضدات مسؤول عن تطوير الاستجابة المناعية؛ ما يؤدي إلى HDFN، في حين أن العديد منها ليس كذلك. يعترف فريق عمل الجمعية الدولية لنقل الدم لعلم الوراثة المناعية للخلايا الحمراء ومصطلحات فصيلة الدم (ISTB WP) بـ 43 نظامًا لفصائل الدم تحتوي على 345 مستضدًا للخلايا الحمراء. ومع ذلك، يتم اكتشاف مستضدات جديدة باستمرار وبالتالي يستمر التعرف على المستضد المحتمل: مجمعات الأجسام المضادة في الزيادة. وتعرف مستضدات كرات الدم الحمراء في أنظمة فصائل الدم المختلفة بأنها بروتينات أو جليكوليبيدات وقد يكون لها وظائف مختلفة.

نظام Rh
مستضدات كرات الدم الحمراء المختلفة، داخل وبين أنظمة فصيلة الدم المختلفة، لها تأثير مختلف على إنتاج الأجسام المضادة، ولكن نسبة صغيرة فقط من هذه المستضدات تسبب عدم توافق الخلايا الحمراء ذات الصلة سريريًا. المستضد السطحي الأكثر شيوعًا لكرات الدم الحمراء المشاركة في شكل حاد من HDFN هو عامل Rhesus، الذي تم اكتشافه في أربعينيات القرن العشرين في قرود Rhesus.
نظام فصيلة الدم Rh هو ثاني أهم نظام سريري بعد نظام ABO. بقدر ما نعلم حتى الآن، يتكون نظام Rh من 55 مستضدًا موروثًا سطحيًا أهمها مستضدات D وC وc وE وe التي يتم تدوينها بواسطة جينين متماثلين للغاية، RHD وRHCE.
المستضد الأكثر مناعة هو مستضد D (RhD). يعد الشخص إيجابيًا للعامل الريسوسي (RhD+) أو سلبيًا للعامل الريسوسي (RhD-) بناء على وجود أو عدم وجود مستضد RhD على سطح كرات الدم الحمراء. لم يثبت وجود المستضد d مطلقًا. المستضدات موروثة في مجموعتين من ثلاثة، مجموعة واحدة من كل من الأبوين. المجموعات الأكثر شيوعًا هي CDe(R1) و c(d)e(r) و cDE(R2)
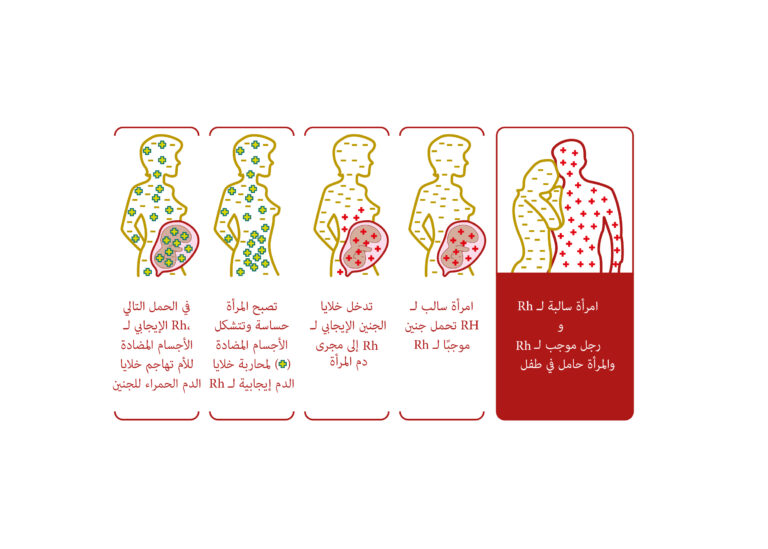
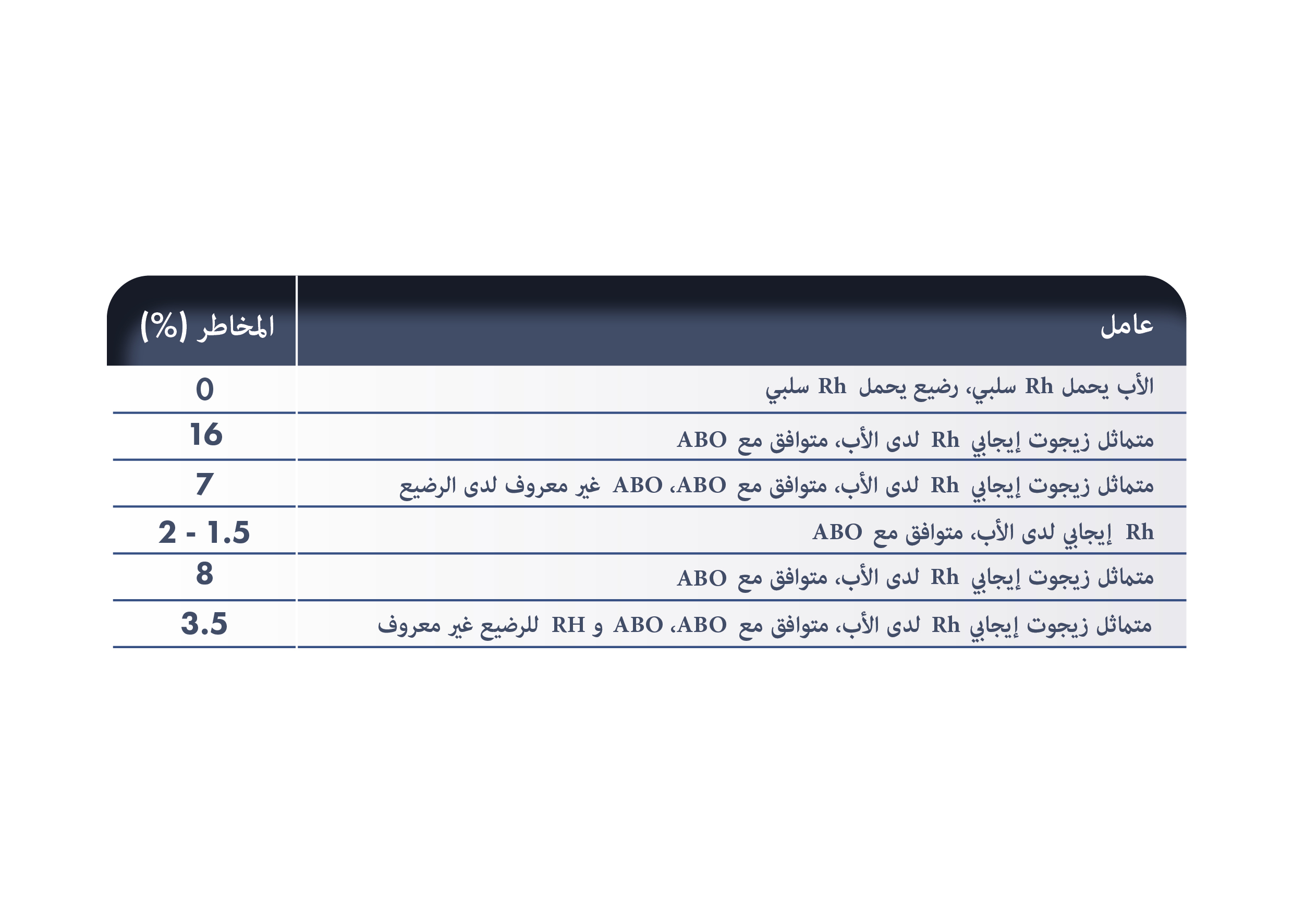
أقل بقليل من 50% من الأشخاص المصابين ب Rh متماثلون بالنسبة لـ D (أي أنهم ورثوا مجموعة من المستضدات التي تحتوي على D من كلتا المجموعتين من الوالدين). إذا كان الشريك الإيجابي لامرأة سالبة Rh متماثل الزيجوت، فسيكون جميع أطفاله إيجابيين لـ Rh بينما إذا كان متغاير الزيجوت، فسيكون الجنين سالباً لـ Rh أو إيجابيًا لـ Rh مع فرصة متساوية. فقط الأجنة الإيجابية لـ Rh يمكن أن تسبب المناعة لـ Rh وإنتاج الأجسام المضادة D في النساء السالبات لـ RhD، يحدد الجنين الكريات الحمر في الأجنة الإيجابية لـ RhD. مستضد D موجود بالفعل من الأسبوع السادس/السابع من الحمل و0.1 مل من خلايا الدم الحمراء الجنينية D + يمكن أن تحصن الأم السلبية لـ Rh. تختلف الإيجابية لـ RhD بين الأعراق: حيث تبلغ 85٪% من القوقازيين، و95% في أفريقيا جنوب الصحراء الكبرى، وأكثر من 99.5% في شرق آسيا.
ما المقصود يالمستضد المسؤول عن أشد حالات HDFN؟
مستضد RhD هو الأكثر مناعة بين مستضدات نظام Rh ويرتبط الجسم المضاد لـ D بأعلى خطر لوفيات الجنين واعتلاله. غالبًا ما تكون مستضدات الريسوس بخلاف RhD، بما في ذلك c وC وE وe ضمن الأسباب، ويمكن أن تنتج انحلال الدم الشديد. ومع ذلك، من المعروف أيضًا أن المستضدات من أنظمة فصيلة الدم Kell وDuffy وMNS وKidd تسبب شكلاً حادًا من HDFN. من المهم فهم حالات عدم توافق خلايا الدم الحمراء المختلفة وإنتاج الأجسام المضادة التي تسبب HDFN للتنبؤ بحالات الحمل وحديثي الولادة المعرضين لخطر آثار مرض انحلال الدم الجنيني والوليدي ومنعها ومراقبتها وإدارتها.
ما المقصود بالفيزيولوجيا المرضية لـHDFN؟
يحدث HDFN عندما يرث الجنين أو حديث الولادة مستضد كرات الدم الحمراء من الأب غير الموجود في خلايا الدم الحمراء للأم. مستضد كرات الدم الحمراء غير الذاتي يثير إنتاج الأم لجسم مضاد محدد. تنتقل الأجسام المضادة IgG للأمهات عبر المشيمة إلى مجرى دم الجنين، وترتبط بالمستضد الأجنبي وتسبب انحلال الدم وفقر الدم المحتمل. فقر الدم الجنيني يحفز الكريات الحمر التعويضية، ومع ذلك قد تكون هذه الآلية غير كافية. يؤدي التعويض عن فقر الدم إلى زيادة ديناميكية الدورة الدموية في الجنين ما يسبب تضخم القلب والفشل الكبدي. يؤدي فشل الكبد إلى انخفاض مستويات البروتين وانخفاض ضغط الأورام في الدورة الدموية ويؤدي قصور القلب إلى زيادة الضغط الوريدي، والمزيج منه يؤدي إلى وذمة معممة واستسقاء، والمعروفة باسم استسقاء الجنين، والتي يصاحبها ارتفاع معدل الوفيات في الفترة المحيطة بالولادة.
يؤدي انحلال الدم في الخلايا الحمراء الجنينية إلى ارتفاع مستويات البيليروبين. بما أن البيليروبين يمر بالمشيمة، تتم إزالة فائض البيليروبين عن طريق الدورة الدموية للأم في أثناء الحمل. بعد الولادة، تستمر العملية الانحلالية، ولكن الكبد غير الناضج نسبيًا لحديث الولادة لا يمكنه أن يستوعب فائض البيليروبين بما فيه الكفاية. قد يؤدي هذا إلى فرط بيليروبين الدم الشديد وحتى في تلف لا رجعة فيه للجهاز العصبي المركزي، وهي حالة تعرف باسم اليرقان. تتميز هذه الحالة بترسب البيليروبين في العقد القاعدية ونوى جذع الدماغ وترتبط بالحالات المرضية طويلة الأجل مثل الشكل الحاد من الشلل الدماغي اللاثيدي ومشاكل السمع والإعاقات الحركية.
التشخيص قبل الولادة
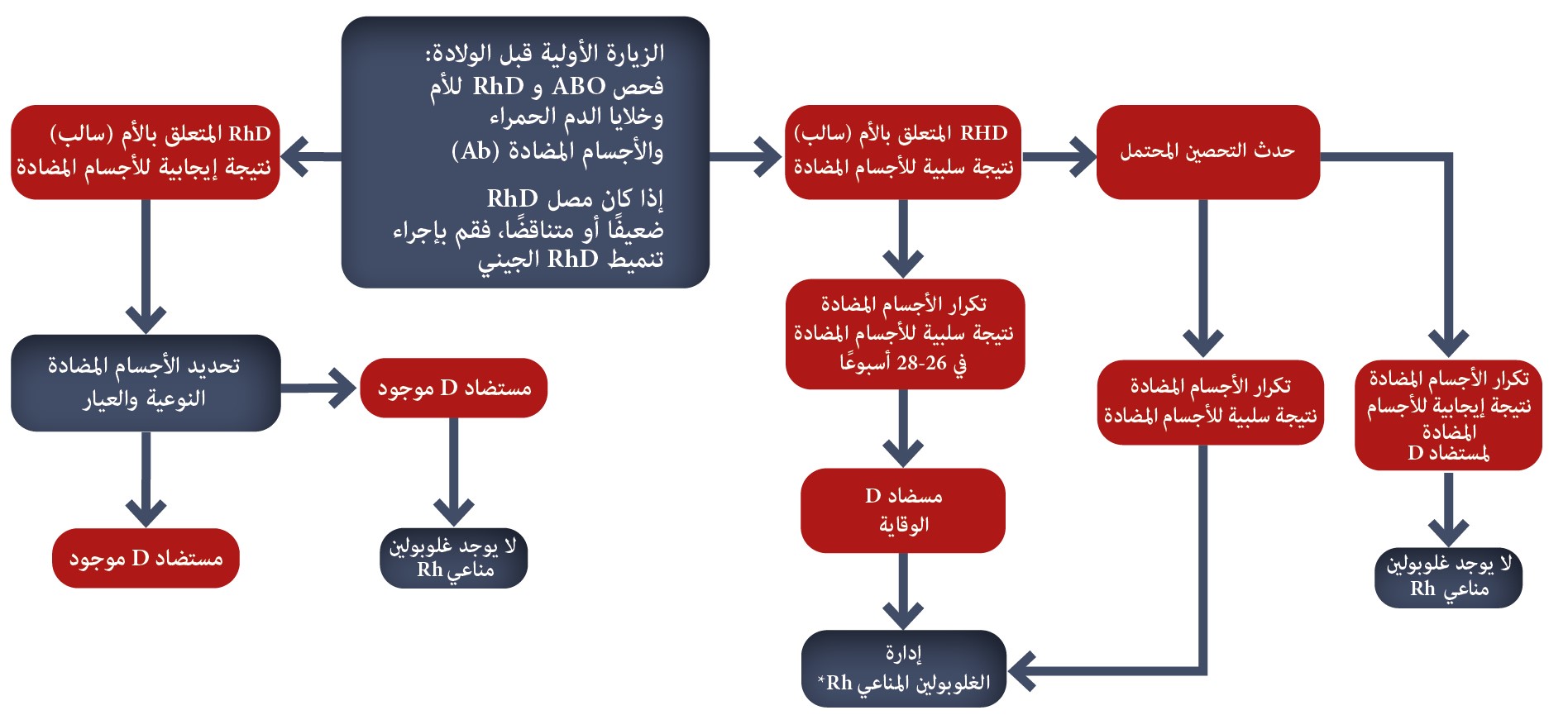
عادة ما يتم تشخيص مرض Rh في أثناء الفحص الروتيني قبل الولادة. يمكن أن يؤدي التنبؤ بحالة RhD الجنينية عن طريق الفحص غير الجراحي قبل الولادة لجين RhD الجنيني (RHD) إلى توجيه الاستخدام المستهدف للوقاية المضادة لـD قبل الولادة.
ما المقصود بـHDFN في الحمل؟
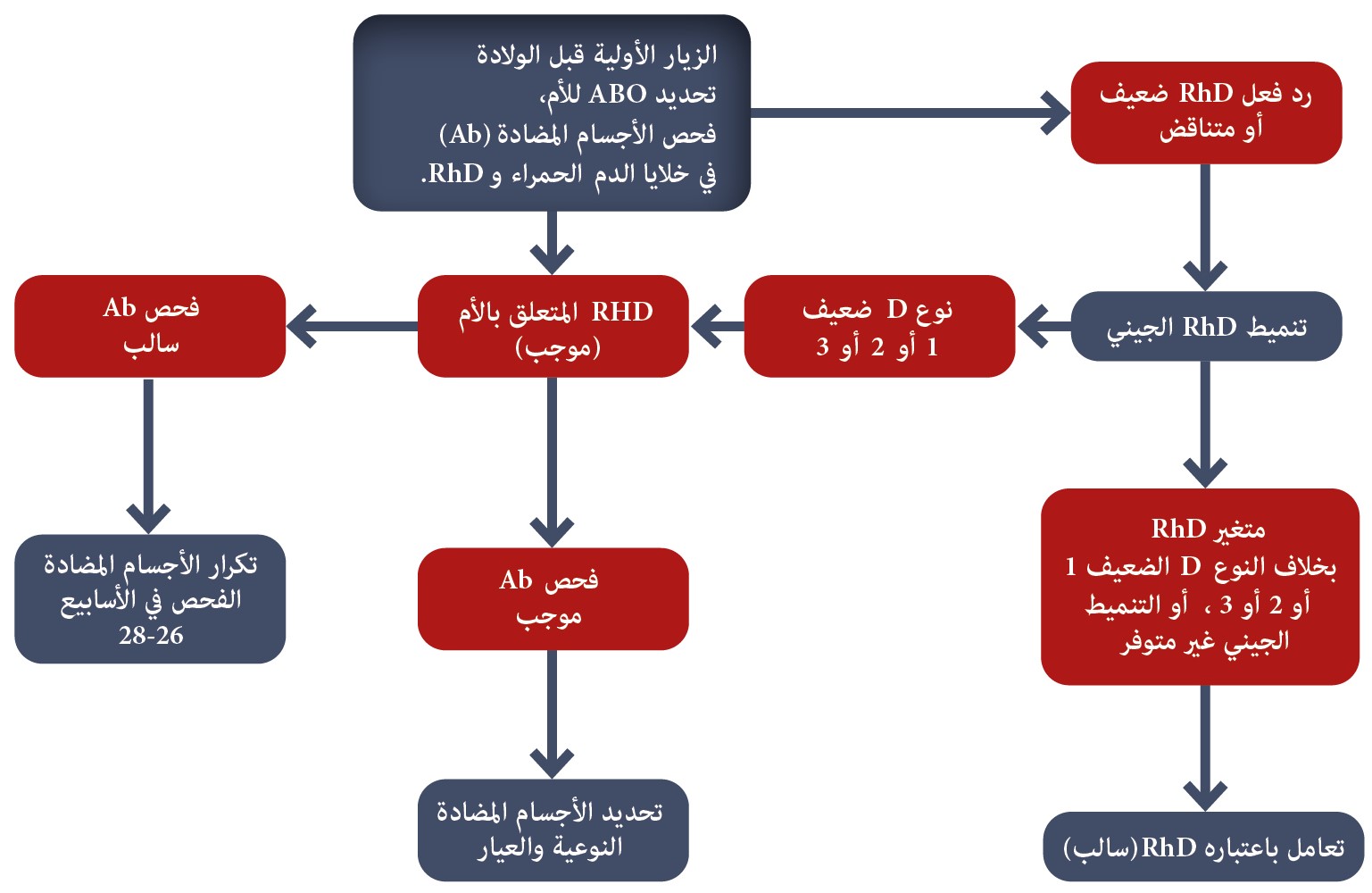
يجب اختبار كل امرأة في أثناء الحمل لتحديد فصيلة الدم وفحص الأجسام المضادة لتحديد حالة Rh ووجود تحصين يعرض الجنين لخطر الإصابة بمرض انحلال الدم للجنين والوليد (HFDN) المعروف أيضًا باسم داء أرومات الدم الحمراء الجنيني.
وفقًا للأكاديمية الأمريكية لطب الأطفال (AAP)، “إذا لم يكن لدى الأم فصيلة دم قبل الولادة أو كانت سلبية لـ Rh، يوصى بشدة بإجراء اختبار مباشر للأجسام المضادة (أو اختبار كومبس) وفصيلة الدم ونوع Rh (D) على دم الرضيع (الحبل السري) “.
تم فحص فصيلة الدم والكشف عن الأجسام المضادة غير المنتظمة لكرات الدم الحمراء في الأسبوع 28 من الحمل. يجب تحديد حالات Rh وABO لوالد جنين امرأة حامل سلبية لـ Rh. إذا كان متغاير الزيجوت، فإن خطر التحصين لـ Rh ينخفض إلى النصف. إذا كان النمط الجيني ABO وRh للأب معروفًا، فيمكن تقدير خطر التحصين ضد Rh.
من المهم إعادة الاختبار بانتظام للمرأة الحامل ذات العامل الريسوسي السلبي التي لديها شريك إيجابي للعامل الريسوسي. يجب إجراء مزيد من الاختبارات في الأسابيع من 18 إلى 20 من الحمل وكل 4 أسابيع بعد ذلك مع الأخذ في الحسبان أن الاستجابة المناعية الأولية نادرًا ما تحدث قبل الأسبوع 20 من الحمل.
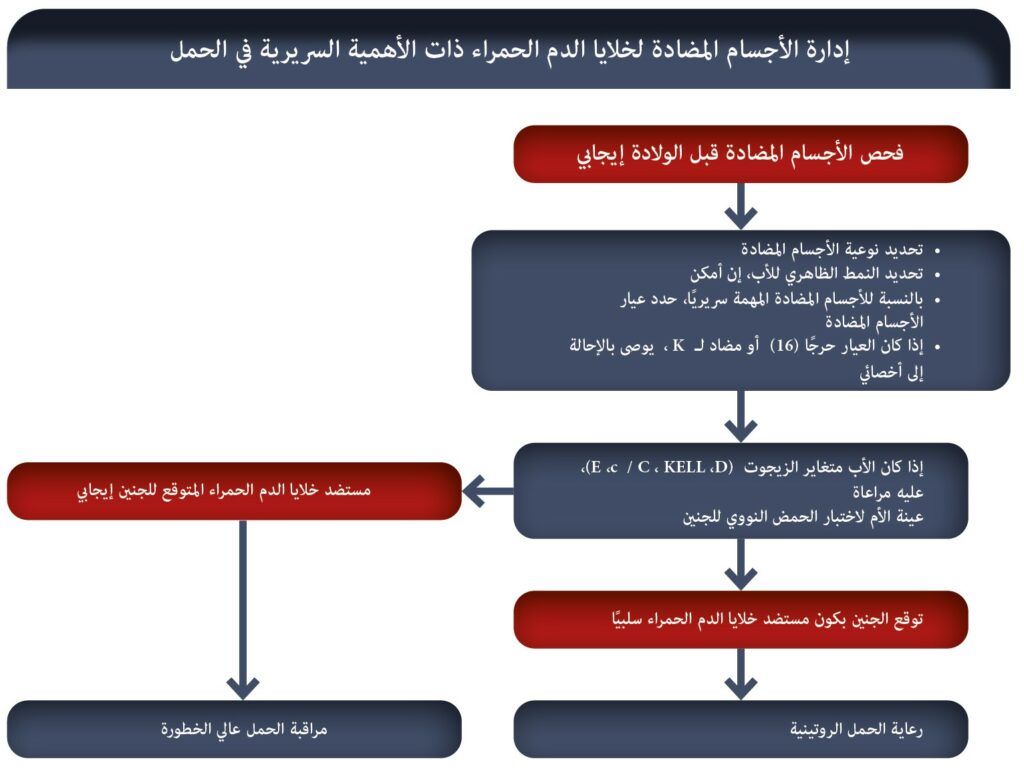
ما الأجسام المضادة للخلايا الحمراء المهمة سريريًا؟
عندما لا يتم الكشف عن وجود أو تطور الأجسام المضادة للخلايا الحمراء في أثناء الحمل، فإن السمات السريرية الوحيدة وغير المحددة وغير المتوقعة لـHDFN في أثناء الحمل هي انخفاض حركات الجنين أو موت الجنين المفاجئ.
عندما يتم تحديد وجود الأجسام المضادة للأم لـ Rhعن طريق الفحص، يجب مراقبة المرأة الحامل عن طريق الاختبارات المعملية المتكررة (عيار الأجسام المضادة، كمية الأجسام المضادة، السمية الخلوية المعتمدة على الأجسام المضادة أو ADCC). إذا كانت فحوصات المصل هذه أعلى من مستوى قطع معين، فمن الضروري إجراء فحوصات سريرية في مراكز متخصصة مثل التصوير بالموجات فوق الصوتية Echo-Doppler للكشف في الوقت المناسب عن HDFN الشديد الذي يتطلب علاج الجنين أو الولادة مع علاج حديثي الولادة.
وبالتالي، يهدف برنامج الفحص إلى تحديد حالات الحمل التي تحتاج إلى علاج داخل الرحم للجنين و/أو يجب تحفيز الولادة لتقليل خطر الإصابة بمرض انحلالي حاد. ودون برنامج فحص، قد يتأخر العلاج.
ما الاختبارات المعملية المتضمنة في تشخيص HDFN في أثناء الحمل؟
نظرًا لأن الجنين يمكن أن يصاب بفقر الدم الشديد من الأسبوع السادس عشر من الحمل فصاعدًا، يجب إجراء فصيلة دم الجنين غير الجراحية باستخدام الحمض النووي للجنين الخالي من الخلايا (cff) من بلازما الأم قبل 14-15 أسبوعا من أجل فحص النساء غير المحصنة والسالبة لـ D.
نظرًا لأن الحمض النووي الجنيني من دون خلية لا يمثل سوى جزء بسيط من إجمالي الحمض النووي الخالي من الخلايا في بلازما الأم، فإن تقنية استخراج والكشف عن الحمض النووي عالية الكفاءة والحساسة، بالتزامن مع تفاعل البوليميراز المتسلسل الكمي، تعد من الأمور المطلوبة.
تتضمن الطرق الأخرى المطبقة على معرفة نوع RHD الجنيني امتدادًا أحادي القاعدة، ويتبعها عرض للمنتجات المحددة باستخدام GeneScan أو مطياف الكتلة.
في الآونة الأخيرة، تم وصف تفاعل البوليميراز المتسلسل الرقمي القائم على الشريحة لفصيلة دم الجنين. تسمى هذه الطريقة PCR الرقمي بالقطرات (ddPCR). في ddPCR، تحتوي كل قطرة على نسخة واحدة فقط من جين الأم أو الجنين، وبالتالي فإن وجود نسخة جنينية سيؤدي دائمًا إلى إشارة إيجابية قوية يمكن تمييزها بسهولة عن القطرات التي تحتوي على نسخ الحمض النووي للأم.
تستخدم بعض المختبرات تأكيد وجود الحمض النووي للجنين مع تسلسلات الحمض النووي الأخرى الموروثة من الأب (مثل SRY) أو العلامة العالمية للحمض النووي للجنين (مثل RASSF1a الميثيلي) للإبلاغ عن نتائج قاطعة في فحص واحد. يمكن استنتاج أن التنميط الجيني الجنيني غير الجراحي يمكن استخدامه بشكل موثوق لاستهداف المراقبة المختبرية والسريرية للحالات المعرضة لخطر الإصابة بداء HDFN الشديد.
درجة شدة الداء الانحلالي
في النساء المحصنات والسالبة لـ Rh، من الأهمية بمكان تحديد درجة شدة داء أرومات الدم الحمراء (إن وجدت) في الجنين.
هنالك ست معاملات قد تساعد في تقييم درجة شدة الداء الانحلالي:
1) تاريخ المرض السابق
2) عيار الأجسام المضادة للأمهات
3) المقايسات الوظيفية للأجسام المضادة للأم باستخدام الخلية
4) القياسات الطيفية للسائل الأمنيوسي
5) تقييم الموجات فوق الصوتية
6) أخذ عينات دم الجنين مباشرة.
تعريف الشدة كما يلي:
- تشير عبارة “HDFN الشديد جدًا” إلى حالات الوفاة داخل الرحم والحالات التي يتم علاجها عن طريق عمليات نقل الدم داخل الرحم (IUTs) و/أو نقل الدم المتبادل (ET) بعد الولادة.
- يشمل “HDFN الشديد” أيضًا الحالات التي يتم علاجها بعمليات نقل الدم الإضافية والحالات التي يلزم فيها الحث على المخاض قبل الأوان.
- يتم تعريف “الدورة الخفيفة” على أنها الحالات التي لا تحتاج إلى الحث على المخاض قبل الأوان والتي يكفي فيها بالعلاج بالضوء.
مخاطر بزل السائل الأمنيوسي والحث على الولادة المبكرة
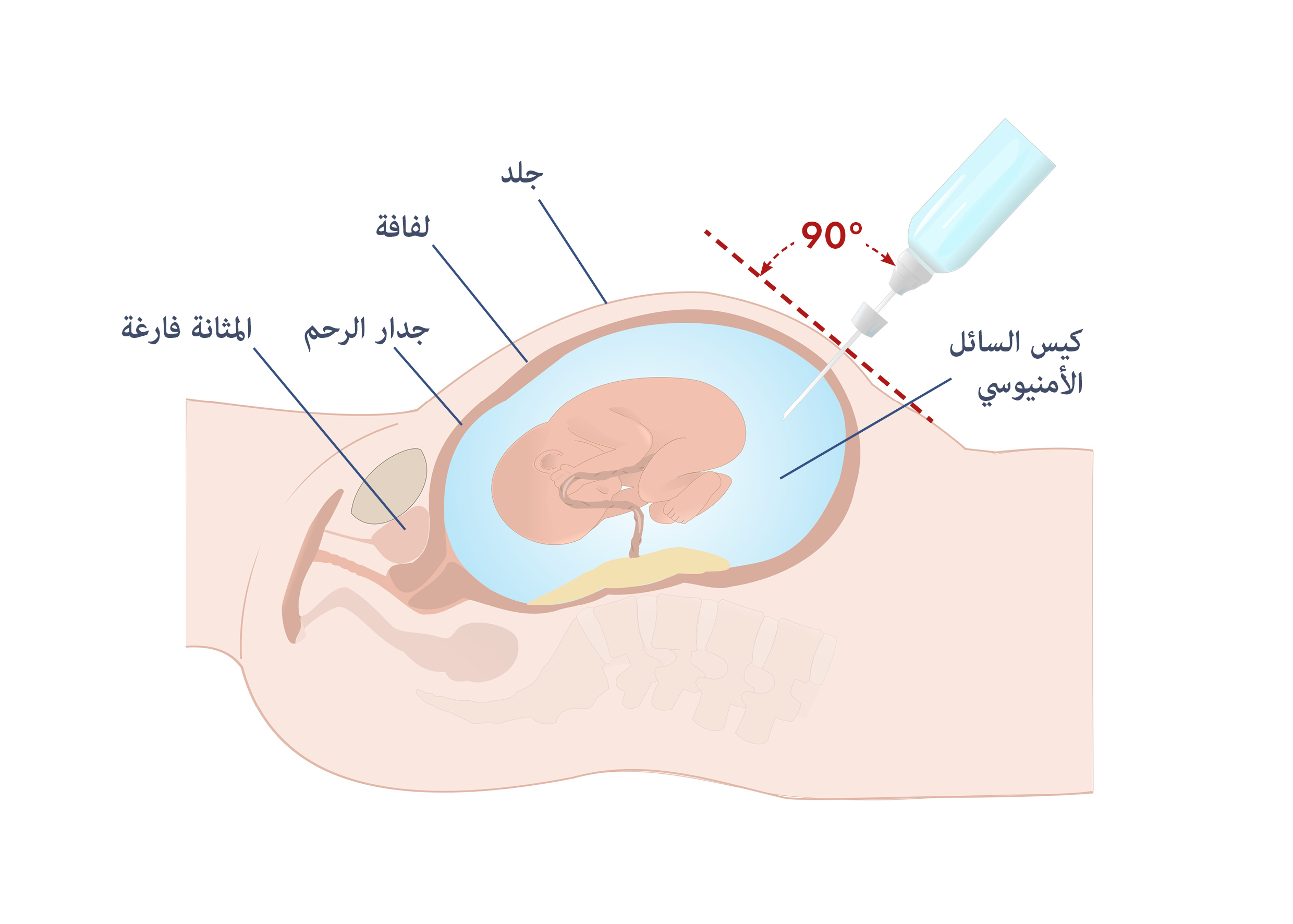
يجب أن يوضع في الحسبان أنه نظرًا لخطر نزيف الجنين الأمومي (FMH) الموجود دائمًا، مع ما يترتب على ذلك من زيادة عيار الأجسام المضادة وزيادة شدة انحلال الدم، يجب إجراء بزل السائل الأمنيوسي فقط بعد تحديد موقع المشيمة بالموجات فوق الصوتية بعناية. يرتبط بزل السائل الأمنيوسي الذي يتم إجراؤه دون توجيه الموجات فوق الصوتية بخطر الإصابة بنسبة 10% – 11% من FMH وزيادة شدة داء أرومات الدم الحمراء. ومع ذلك، حتى لو كان بالموجات فوق الصوتية الموجهة، فإن بزل السائل الأمنيوسي قد يحدد FMH لأنه مناورة جراحية. وبالتالي، يجب أن يتم ذلك فقط إذا كان التاريخ أو عيار الأجسام المضادة يشير إلى أن الجنين معرض لخطر الإصابة بالاستسقاء والموت. بغض النظر عن عيار الأجسام المضادة، يجب إجراء بزل السائل الأمنيوسي في الأسبوع 18 إلى 19 من الحمل في حالة تاريخ الإملاص السابق أو إذا كان المولود السابق يحتاج إلى ET بعد الولادة. في حالة عدم وجود هذا التاريخ، يجب إجراء بزل السائل الأمنيوسي فقط إذا كان عيار الأجسام المضادة يشير إلى وجود خطر ثابت بحدوث الاستسقاء.
إنه فقط الجنين الذي سيكون مصابا بالاستسقاء الجنيني قبل الأسبوع 34 من الحمل هو الذي يجب أن يخضع لعمليات نقل دم الجنين، ويجب أن يتعرض هؤلاء الأجنة فقط وأولئك الذين سيصبحون مصابين بالاستسقاء الجنيني بين الأسبوع 34 من الحمل والولادة لمخاطر الولادة المبكرة المستحثة. يبلغ خطر الوفاة المرتبط بصدمة نقل الدم الجنيني (داخل الصفاق) ما بين 10-15% في الأسابيع 22 إلى 23 من الحمل وينخفض إلى 3-5% بعد الأسبوع 28. في الرضيع السابق لأوانه ممن لديه كريات الدم الحمراء مصابة بمرض شديد، لا يزال خطر الوفاة كبيرًا في الوقت الحاضر في الأسبوع 32 من الحمل.
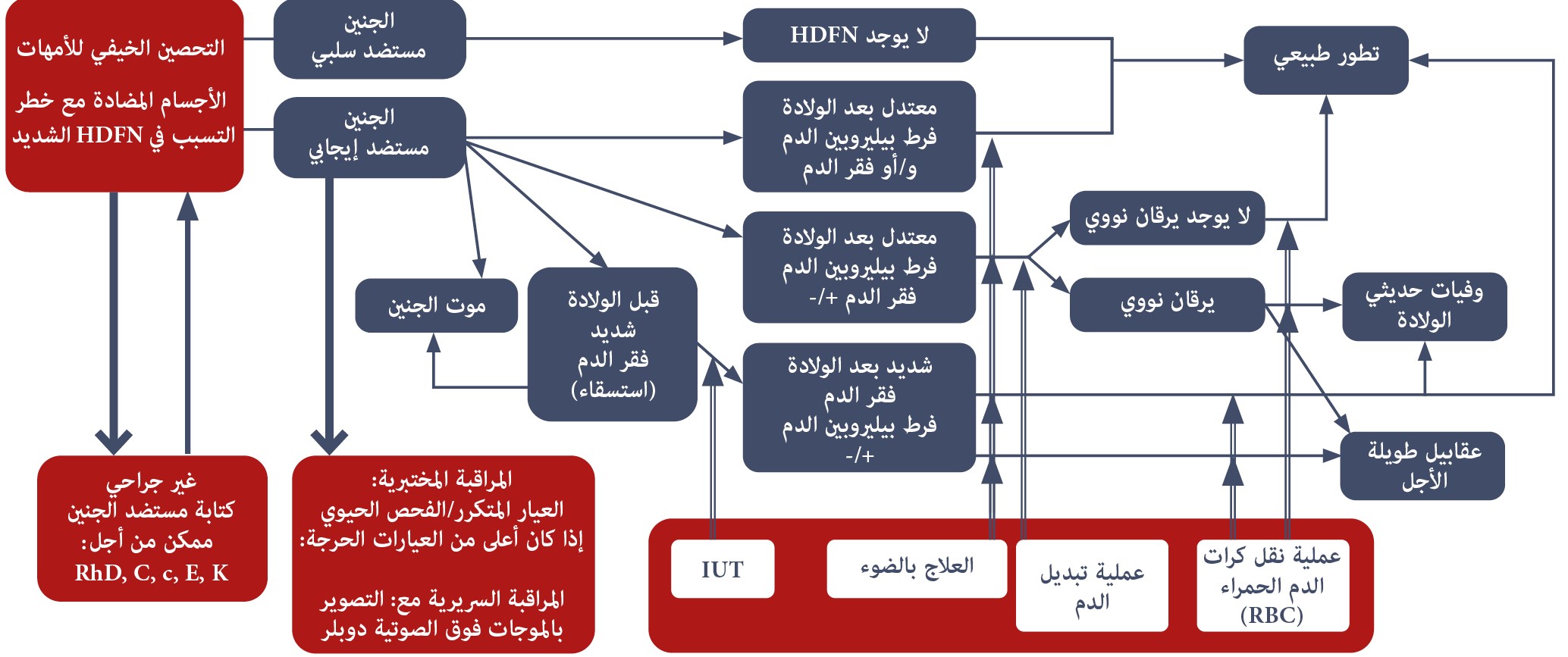
نموذج مرض المناعة المتباينة للأمهات الذي يؤدي إلى مرض انحلال الدم للجنين والوليد والاختبارات المعملية والاختبارات السريرية في نهاية المطاف للتمييز بين الحالات عالية الخطورة. تم التعديل بواسطة Haas M وآخرين، 2015.
*في حالة عدم إتاحة تحديد نوع مستضد الجنين غير الجراحي، يجب مراقبة حالات الحمل كما لو كان الجنين إيجابيًا للمستضد عندما يكون الأب البيولوجي متماثل الزيجوت أو إيجابيًا متغاير الزيجوت للمستضد المعني.
يمكن مراقبة حالات الحمل كما لو كان الجنين سلبيًا للمستضد بناءً على نتيجة تحديد نوع المستضد الجنيني السلبي غير الجراحي، أو عندما يتم تحديد الأب البيولوجي بشكل مؤكد على أنه سلبي متماثل الزيجوت للمستضد المعني.
تقييم ما بعد الولادة
لدى العديد من النساء دم جنين قليل أو معدوم في الدورة الدموية في أثناء الحمل، وبعد ذلك فقط يكون ذلك بكميات صغيرة (<0.1 مل) قد تزيد قليلاً في الثلث الثالث من الحمل. بعد الولادة، عادة ما يكون معدل حدوث وحجم FMH أكبر وهذا ما يفسر سبب تحصين النساء بـ D بعد الولادة أكثر من تحصينهن في أثناء الحمل.
وبالتالي، من الأهمية بمكان فحص جميع النساء السلبيات لـ D بعد الولادة بحثًا عن FMH؛ في حالة وجود نتيجة إيجابية، يجب تحديد حجم نزيف الجنين. يمكن أن تؤدي الكميات الكبيرة من FMH إلى وفاة الجنين أو فقر الدم الوليدي الحاد الذي يتطلب نقل الدم الفوري.
تحتاج النساء السلبيات لـ D إلى تلقي جرعة كافية من الغلوبولين المناعي المضاد لـ (anti-D Ig) لتدمير جميع كرات الدم الحمراء الجنينية في الدورة الدموية لمنع التحصين بـ D؛ مما يشكل مخاطر HDFN في حالات الحمل الإيجابية لـ D في المستقبل.
ما نتائج الداء الانحلالي لتقييم الجنين وحديثي الولادة؟
يجب الأخذ في الحسبان مرض انحلال الدم للجنين وحديثي الولادة في التشخيص التفريقي لحديثي الولادة المصابين باليرقان/فرط بيليروبين الدم وبالتأكيد في حالة فقر الدم الوليدي.
عند الولادة، يتم قطع الاتصال بالدورة الدموية للأم، بسبب التطور غير الناضج للمسار الأيضي لتحطيم البيليروبين في الكبد الوليدي، مما يزيد خطر فرط بيليروبين الدم الوليدي بشكل كبير. يعد علاج فرط بيليروبين الدم أمرًا بالغ الأهمية في فترة حديثي الولادة بسبب خطر الإصابة بالاعتلال الدماغي الناجم عن البيليروبين.
بالنسبة لحديثي الولادة الذين يعانون من HDFN المعروف، فإن المراقبة الدقيقة لمستويات البيليروبين والهيموجلوبين إلزامية لتحديد ما إذا كانت هناك حاجة إلى نقل تبادل حديثي الولادة لغسل البيليروبين والأجسام المضادة للأم، و/أو إذا تم الإشارة إلى عمليات نقل الدم لدعم قدرة حمل الأكسجين إلى الأنسجة. يجب مراقبة الرضع بعناية بحثًا عن العلامات السريرية لفقر الدم المستمر، والذي يتجلى على الأرجح في سوء التغذية، وهو النشاط الأكثر هوائية لحديثي الولادة. قد يكون لديهم أيضًا زيادة في النوم مع تفاقم فقر الدم.
في فقر الدم المستمر، قد ينخفض إنتاج الخلايا الشبكية من نخاع عظم الجنين، ويمكن أن تتأثر خطوط الخلايا الأخرى، مثل خلايا الدم المتعادلة. ستساعد المراقبة الأسبوعية للخلايا الشبكية والهيماتوكريت في توجيه عملية صنع القرار بشأن نقل الدم وتوفير الطمأنينة عندما يتعافى النخاع.
مكتبة
في عام 1968 تمت الموافقة على الغلوبولين المناعي المضاد لـ Rh(D) لمنع ظهور التحسس لمستضد فصيلة الدم Rh(D) Rh(D) بعد الولادة لدى النساء السالبات لـ Rh.
بعد ذلك، تم توسيع الوقاية المضادة لـ Rh(D) لتشمل النساء الحوامل السالبة لـ Rh، وحالات الإجهاض، والحمل خارج الرحم، وبزل السائل الأمنيوسي، والنزيف أو إصابة البطن أثناء الحمل، و/أو نسخة رأسية خارجية للعرض المقعدي.
حتى لو كان هذا النهج فعالا للغاية للوقاية من مرض Rh، فقد أظهرت البيانات الحديثة أنه في حوالي 50% من الحالات المؤهلة في جميع أنحاء العالم، لا يتم إعطاء الغلوبولين المناعي المضاد لـ Rh(D).
إن عدم كفاية المعروض، واعتبارات التكلفة، والجهل، وعدم الحصول على منتج التحصين واستخدام المنتجات التي لم يتم اختبارها للتأكد من فعاليتها العلاجية هي الأسباب الرئيسية لهذه التغطية الوقائية غير المرضية. ولا بد من التأكيد على أن مرض العامل الريسوسي لا يزال يتسبب في وفاة ما يزيد عن 160000 حالة وفاة في الفترة المحيطة بالولادة و100000 حالة عجز سنويُا. تمثل هذه البيانات المثيرة للقلق انخفاضا بنسبة 50% فقط مقارنة بالعصر الذي سبق إعطاء الغلوبولين المناعي، وهو وضع يجب حسبانه غير مقبول بالنظر إلى العبء المرتفع لمرض يمكن الوقاية منه.
نشر الاتحاد الدولي لأمراض النساء والتوليد (FIGO) والاتحاد الدولي للقابلات (IMC) في عام 2021 ورقة توجيهية مشتركة حول الوقاية من أمراض Rh عن طريق الوقاية المناعية، والتي سيتم تلخيصها بإيجاز في هذا القسم.
الاتحاد الدولي لأمراض النساء والتوليد والاتحاد الدولي للقابلات
نشر الاتحاد الدولي لأمراض النساء والتوليد (FIGO) والاتحاد الدولي للقابلات (IMC) في عام 2021 ورقة توجيهية مشتركة حول الوقاية من أمراض Rh عن طريق الوقاية المناعية، والتي سيتم تلخيصها بإيجاز في الأقسام التالية.
فصيلة الدم وتحديد نوع Rh(D)
المعرفة المسبقة بحالة Rh الأمومية إلزامية لمنع حساسية Rh. يفضل تحديد نوع Rh(D) في الأشهر الثلاثة الأولى من الحمل، لأن مؤشرات الوقاية المناعية المضادة لـ Rh(D) قد تظهر في وقت مبكر أثناء الحمل.
إدارة الغلوبولين المناعي المضاد لـ Rh(D) في الحمل
يلعب المخاض دورًا حاسمًا في العديد من حالات التحسس نحو Rh(D). وبالتالي، فإن الوقاية المناعية في أثناء الحمل ذات أهمية أساسية. يمكن إجراء إعطاء الغلوبولين المناعي المضاد لـ Rh(D) قبل الولادة عن طريق الحقن العضلي أو الوريدي. يمكن إعطاؤه مرة واحدة (1500 وحدة دولية) في المدة من 28 إلى 34 أسبوعًا من الحمل، أو مرتين في المدة من 28 و32 إلى 34 أسبوعًا من الحمل (625 وحدة دولية أو 1500 وحدة دولية في كلا عمري الحمل).
الإجهاض
يجب إعطاء الوقاية المناعية فقط للنساء المصابات بإدارة تلقائية أو طبية للإجهاض بعد 10 أسابيع من الحمل. في حالة الإدارة الجراحية للإجهاض، هنالك اقتراح مفاده أنه يمكن النظر في العلاج الوقائي أيضًا قبل 10 أسابيع من الحمل.
الحمل خارج الرحم
ينصح بشدة بإعطاء الغلوبولين المناعي المضاد لـ Rh(D) في حالة الحمل خارج الرحم لأنه ثبت أن حمل قناة فالوب المنتبذ يرتبط بنسبة 24% من المناعة المتباينة لـ Rh(D).
إدارة الغلوبولين المناعي المضاد لـ Rh(D) بعد الولادة
حدث التحسس بـ Rh(D) في 16% من حالات الحمل للنساء السالبات لـ Rh(D) ويقلل إعطاء الغلوبولين المناعي Rh(D) من هذا الخطر إلى 1.5%. وبالتالي، ينبغي أن يمثل هذا التدخل الأولوية القصوى في البلدان/المناطق التي تكون فيها الوقاية غير كافية حاليا أو غير متوفرة.
يجب إعطاء جرعة 1500 وحدة دولية (أو ما يعادلها، 300 ميكروغرام) من مضاد Rh(D) عن طريق الحقن العضلي في غضون 72 ساعة بعد الولادة في النساء السالبات لـ Rh اللائي يلدن طفلاً إيجابيًا لـ Rh.
موت الجنين داخل الرحم
نظرًا لأن وفاة الجنين داخل الرحم قد تكون نتيجة لنزيف جنيني أمومي واضح (FMH)، يجب تحديد مقدار النزيف من خلال الاختبار المناسب، مثل اختبار فحص كلايهاور- بيتكه، لتحديد جرعة الغلوبولين المناعي الصحيحة اللازمة المضادة لـ D.
التحويل الخارجي لرأس الجنين في حالة المجيء المقعدي
ينطوي إجراء التحويل الخارجي لرأس الجنين على خطر الإصابة بـ FMH بنسبة تتراوح من 2 إلى 6%. وبالتالي، ينصح بإعطاء الوقاية المناعية مع الغلوبولين المناعي المضاد لـ Rh(D) في الأسبوع 32 من الحمل.
أخذ عينات الزغابات المشيمية (CVS) أو بزل السائل الأمنيوسي
في معظم البلدان، ولكن ليس في كل البلدان، يقترح إعطاء الغلوبولين المناعي المضاد لـ Rh(D) للنساء الحوامل السلبيات لـ Rh(D) بعد CVS أو بزل السائل الأمنيوسي.
النزيف والصدمات البطنية في أثناء الحمل
ينصح بالوقاية المناعية مع إعطاء الغلوبولين المناعي المضاد لـ Rh(D) في حالة حدوث إصابة في البطن على أساس أن هذه الحالة قد تسبب نقل دم الجنين والأم وبالتالي زيادة في خطر المناعة المتباينة لـ Rh(D). جرعة الغلوبولين المناعي المضاد لـ Rh(D) الأكثر شيوعًا هي 1500 وحدة دولية.
ما المقصود باختبار الحمض النووي الجنيني RhD غير الجراحي؟
يمكن تحديد حالة الجنين Rh(D) عن طريق اختبار ما قبل الولادة غير الجراحي للحمض النووي الخالي من الخلايا الذي يتم إجراؤه في الأشهر الثلاثة الأولى من الحمل. يجب على واضعي السياسات الصحية تضمين هذا الاختبار غير الجراحي كخيار مستقبلي لمكافحة مرض Rh.
كم عدد جرعات الحقن المضادة لـ D التي أحتاجها؟
تختلف جرعة الغلوبولين المناعي المضاد لـ Rh(D) التي يجب إعطاؤها للمرأة الحامل ذات العامل الريسوسي السلبي تبعا للظروف المختلفة.
أولوية عالية
تحديد عامل Rh لدى الأم، ويفضل في الحمل المبكر.
بالنسبة للنساء السالبات لـ Rh(D)، حدد عامل Rh لحديثي الولادة من دم الحبل السري. إعطاء الغلوبولين المناعي المضاد لـ Rh(D) خلال 72 ساعة من الولادة لدى النساء اللواتي لديهن مولود جديد إيجابي بـ Rh(D)، ما لم يكن لديها حساسية بالفعل.
استخدام جرعة من 500 وحدة دولية (100 ميكروغرام) من الغلوبولين المناعي المضاد لـ Rh(D)؛ إذا كانت التكلفة مستطاعة وكانت الإمدادات منه كافية، يمكن إعطاء 1500 وحدة دولية (300 ميكروغرام)، كما هو شائع في البلدان ذات الدخل المرتفع. الطريق العضلي فعال مثل الطريق الوريدي.
أولوية متوسطة
الوقاية الروتينية المضادة لـ Rh(D) في أثناء الحمل: 1500 وحدة دولية (300 ميكروغرام) في الأسبوع 28-34. الوقاية من الغلوبولين المناعي المضاد للعامل الريسوسي (D) (500 وحدة دولية؛ 100 ميكروغرام) بعد الإجهاض الجراحي أو الحمل خارج الرحم (جميع الأعمار الحملية) أو بعد الإجهاض التلقائي أو الطبي/الإجهاض بعد 10 أسابيع.
الوقاية المضادة لـ Rh(D) بعد النزيف، وصدمة البطن أثناء الحمل، و/أو وفاة الجنين (500 أو 1500 وحدة دولية؛ 100 أو 300 ميكروغرام) خلال الثلث الثاني أو الثالث من الحمل. يمكن استخدام اختبار فحص كلايهاور- بيتكه لتقدير الجرعة المثلى.
أولوية منخفضة
الوقاية المضادة للعامل الريسوسي (D) بعد بزل السائل الأمنيوسي، أخذ عينات من الزغابات المشيمية أو نسخة رأسية خارجية (500 وحدة دولية؛ 100 ميكروغرام).

